Распад - комплекс
Cтраница 2
 |
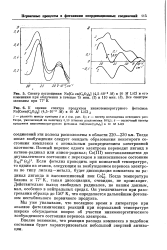
Влияние температуры прокаливания кокса на температуру его самовоспламенения. [16] |
При повышении температуры скорость распада комплекса становится больше скорости его образования. При распаде кислородсодержащего комплекса могут образоваться СО и С02, соотношение которых зависит от среды, кинетических и диффузионных факторов, поверхностной энергии углерода и определяет суммарный тепловой эффект реакции. [17]
Предполагается, что скорость распада комплекса на продукты реакции пропорциональна концентрации комплекса, а не его активности. [18]
 |
Влияние температуры прокаливания кокса на температуру его самовоспламенения. [19] |
При повышении температуры скорость распада комплекса становится больше скорости его образования. При распаде кислородсодержащего комплекса могут образоваться СО и СО2, соотношение которых зависит от среды, кинетических и диффузионных факторов, поверхностной энергии углерода и определяет суммарный тепловой эффект реакции. [20]
В первом случае скорость распада комплекса вновь на катализатор и субстрат значительно больше скорости реакции ( 2), по которой образуется конечный продукт. Эта ситуация, таким образом, соответствует аррениусовской концепции химической реакции, включающей равновесие между реагентами и активированным комплексом; промежуточные комплексы при таком типе катализа часто называют комплексами Аррениуса. Однако концентрация X в ходе реакции поддерживается практически постоянной, поэтому можно применить метод стационарных концентраций ( часть I, стр. Комплекс этого типа часто называют комплексом Вант-Гоффа. [21]
В растворе процесс лимитируется распадом комплекса. [22]
Эта реакция не сопровождается распадом лигноугле-водного комплекса и растворением лигнина. [23]
Разбавление полученных растворов водой вызывает распад комплексов на исходные компоненты, усиливающийся с нейтрализацией кислоты. Свободный эфир всплывает над водой, если последней недостаточно для его растворения. В разбавленной соляной кислоте эфир растворим значительно лучше, чем в воде или в разбавленной верной кислоте. [24]
Разбавление полученных растворов водой вызывает распад комплексов на исходные компоненты, усиливающийся с нейтрализацией кислоты. Свободный эфир всплывает над водой, если последней недостаточно для его растворения. В разбавленной соляной кислоте эфир растворим значительно лучше, чем в воде или в разбавленной серной кислоте. [25]
Определяющим моментом скорости реакции является распад нуклеофильного комплекса. Таким образом, эта ионная реакция и обусловлена способностью кремния к образованию пятой ковалент-ной связи за счет наличия у него вакантных З - орбит. [26]
Считают, что реакция включает распад триплетного комплекса кетона с бораном. [27]
Вполне возможно, что реакция распада комплекса в подобном состоянии будет характеризоваться небольшой энергией активации. [29]
Величина к представляет собой вероятность распада комплекса на продукты реакции. Если обратного распада нет, то все комплексы образуют только продукты. Трансмиссионный коэффициент в этом случае обращается в единицу. [30]
Страницы: 1 2 3 4