Распад - активированный комплекс
Cтраница 1
Распад активированного комплекса, в результате которого один или несколько атомов переходят от одного реагирующего вещества к другому. [1]
Скорость распада активированного комплекса подчиняется обычному выражению для реакции мономолекулярного распада. [2]
Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации, то эта реакция экзотермическая, в противоположном случае - эндотермическая. Примером эндотермической реакции может служить процесс, обратный экзотермической реакции ( A BC D) - образование веществ А и В из С и D. Эндотермическим реакциям для их протекания требуется непрерывный подвод энергии извне. [3]
Если при распаде активированного комплекса выделяется больше энергии, чем это необходимо для активации частиц, то реакция экзотермическая. Для протекания эндотермических реакций требуется подвод энергии извне. [4]
Если при распаде активированного комплекса энергии выделяется больше, чем затрачено для активации частиц, то реакция будет экзотермической, в противном случае - эндотермической. [5]
 |
Изменение энергии реагирующей системы. [6] |
Если при распаде активированного комплекса энергии выделяется больше, чем это необходимо для активации частиц, то реакция будет экзотермической, в противном случае - эндотермической. [7]
Скорость реакции определяется распадом активированного комплекса на продукты реакции. [8]
Итак, имеются две возможности распада активированного комплекса: 1) на две исходные молекулы - СО и NO2, которые будут повторять свой прежний путь по кривой, или 2) на молекулы СО2 и NO. Последняя возможность представлена движением вниз по ветви кривой вправо от барьера. Пологий участок кривой справа показывает, что молекулы СО2 и NO удалены друг от друга на достаточно большое расстояние и не оказывают взаимного влияния, а потенциальная энергия активированного комплекса снова перешла в кинетическую. [9]
Константу скорости k можно рассматривать как частоту распада активированного комплекса, благодаря которой образуется продукт. [10]
Этот параграф посвящен рассмотрению механизма реакций изотопного обмена наиболее обычного типа, лимитирующей стадией которых является распад активированного комплекса, приводящий к перегруппировке химических связей. При этом молекулы двух разных веществ должны взаимодействовать друг с другом. В простом случае реакций симметрического обмена, когда активированный комплекс образуется в результате благоприятных столкновений между самими реагирующими веществами, активированный комплекс может распадаться по двум направлениям. Одно из них приводит к исходному сочетанию атомов; в результате другого также образуются молекулы исходных веществ, с той разницей, что обменивающиеся атомы меняются в них своими местами. Хорошей иллюстрацией такого механизма может служить реакция изотопного обмена между галоген-ионом и галогеном, причем активированным комплексом в этом случае является, повидимому, тригалоген-ион. [11]
Эта частота значительно меньше, чем нормальная молекулярная колебательная частота, так как движение связано с распадом активированного комплекса. [12]
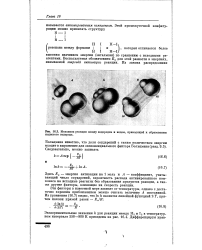 |
Механизм реакции между водородом и иодом, приводящей к образованию йодистого водорода. [13] |
Здесь Еа - энергия активации на 1 моль и А - коэффициент, учитывающий число соударений, вероятность распада активированного комплекса на исходные реагенты без образования продуктов реакции, а также другие факторы, влияющие на скорость реакции. [14]
Таким образом, из экспериментальных данных по температурной зависимости энергии активации невозможно установить, является ли частота, соответствующая распаду активированного комплекса, действительной или мнимой. [15]
Страницы: 1 2 3 4