Распад - активированный комплекс
Cтраница 2
Эта частота значительно меньше, м нормальная молекулярная колебательная частота, так как дви -: ние связано с распадом активированного комплекса. [16]
Действие активатора предполагает изменение реакционной способности катализатора на всех стадиях взаимодействия его с субстратом - при образовании, перестройке и распаде активированного комплекса. [17]
В уравнениях (10.8) - (10.11) величина Еа - энергия активации на 1 моль и А - коэффициент, учитывающий число соударений, вероятность распада активированного комплекса на исходные реагенты без образования продуктов реакции, а также учитывающий другие факторы, влияющие на скорость реакции. [19]
Па / ( К-моль), абсолютную температуру Т, энтропийный множитель e s / R, который отражает вероятность образования переходного состояния, а также трансмиссионный коэффициент х, учитывающий возможность распада активированного комплекса на молекулы исходных веществ. В большинстве химических реакций к близок к единице. [20]
Если активированный комплекс образован ПА В атомами, то можно предположить, что одно из [ 3 ( гсА Пв) - 6 ] нормальных колебаний, а именно то колебание, которое приводит к распаду активированного комплекса до продуктов, будет намного слабее, чем остальные. Эта величина - частота колебания, приводящего к распаду активированного комплекса до продуктов, - и представляет собой по существу константу скорости kz распада активированного комплекса. [21]
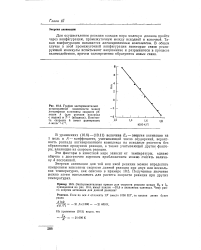
Как видно из рисунка 83, затраченная на активацию молекул энергия затем, при образовании продуктов реакции, полностью или частично выделяется. Если при распаде активированного комплекса выделится энергии больше, чем это необходимо для активирования молекул, то реакция экзотермическая, в противном случае - эндотермическая. [22]
 |
Энергетическая схема хода реакции А2 - f В2 2АВ. [23] |
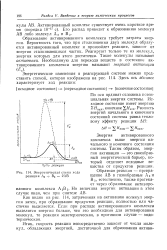
Как видно из рис, 114, затраченная на активацию молекул энергия затем, при образовании продуктов реакции, полностью или частично выделяется. Если при распаде активированного комплекса выделится энергии больше, чем это необходимо, для активирования молекул, то реакция экзотермическая, в противном случае - эндотермическая. [24]
 |
Энергетическая схема хода реакции Л2 - г В2 2АВ. [25] |
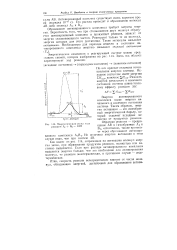
Как видно из рис. 114, затраченная на активацию молекул энергия затем, при образовании продуктов реакции, полностью или частично выделяется. Если при распаде активированного комплекса выделится энергии больше, чем это необходимо для активирования молекул, то реакция экзотермическая, в противном случае - эндотермическая. [26]
При этом в ходе реакции яз частиц реагирующих веществ образуется промежуточная неустойчивая группировка, называемая переходным состоянием или активированным комплексом ( точка L), последующий распад которого приводит к образованию конечных продуктов С и D. Если при распаде активированного комплекса энергии выделяется больше, чем это необходимо для активации молекул, то реакция будет экзотермической, в противном случае - эндотермической. [27]
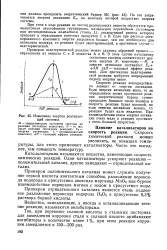 |
Изменение энергии реагирующей системы. [28] |
При этом в ходе реакции из частиц реагирующих веществ образуется промежуточная неустойчивая группировка, называемая переходным состоянием или активированным комплексом ( точка L), последующий распад которого приводит к образованию конечных продуктов С и D. Если при распаде активированного комплекса энергии выделится больше, чем это необходимо для активации молекул, то реакция будет экзотермической, в противном случае - эндотермической. [29]
Страницы: 1 2 3 4