Распад - перекись - водород
Cтраница 2
Для некоторых реакций в растворах ( распад перекиси водорода в присутствии железосодержащих катализаторов и распад пировиноградной кислоты в присутствии аминов) уравнение ( 134) было подтверждено экспериментально. [16]
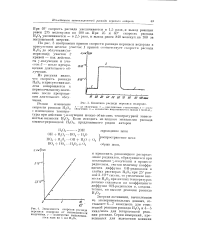 |
Зависимость скорости распада перекиси водорода от интенсивноеги излучения, v - количество выделившегося газа из 1 мл Н20о. [17] |
На рис. 3 изображена кривая скорости распада перекиси водорода в присутствии железа: участок 1 кривой соответствует скорости распада Н202 до облучения ( самораспад); участок 2 кривой - под действием у-излучения и участок - 3 - после прекращения длительного облучения. [18]
В настоящей работе проведено исследование реакции распада перекиси водорода в концентрированных ( - 80 %) растворах под действием у-излу-чения. Особое внимание обращено на изучение влияния поверхности полупроводников ( Fe2O3), на возбуждение гетерогенного радиационно-химического процесса. [19]
Примерами такого влияния являются катализ ионами железа распада перекиси водорода и открытое еще в 1903 г. Титовым каталитическое действие следов меди на окисление сернистого газа. [20]
Как видно из таблицы, энергия активации распада перекиси водорода практически не зависит от концентрации Н2О2 в растворе. [21]
Примерами такого влияния являются катализ ионами железа распада перекиси водорода и открытое еще в 1903 г. Титовым каталитическое действие следов меди на окисление сернистого газа. [22]
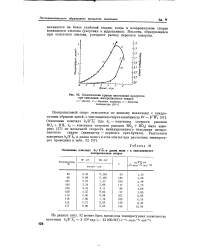 |
Кинетические кривые накопления продуктов. [23] |
Кислоты, образующиеся при окислении ацетона, ускоряют распад перекиси водорода. [24]
 |
Промежуточные продукты гомогенного каталитического распада перекиси водорода. [25] |
Учет образования неактивного продукта при расчете скоро сти распада перекиси водорода был сделан Н. И. Кобозевым ( 1941 г.), предложившим следующую схему. [26]
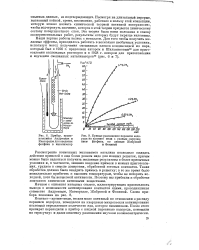 |
Прибор, применявшийся Андреевым и Кавтарадзе для введения фосфина в катализатор.| Кривые разложения перекиси водорода на хромите меди с разным содержанием фосфина, по данным Жабровой и Фокиной. [27] |
Контакт-хромит меди, весьма мало активный по отношению к распаду перекиси водорода, помещался на кварцевые микровесы и активированно поглощал определенное количество яда, которое взвешивали. После этого препарат переводили в прибор с жидкой перекисью водорода, помещали на трясучку и далее кинетику разложения изучали волюмометрически. [28]
Из каталитических процессов с участием кислорода митоэдри-ческим методом был изучен распад перекиси водорода и окисление спиртов и альдегидов. [29]
Из приведенных в табл. 1 данных следует, что скорость распада перекиси водорода в изопропиловом спирте примерно в 2 раза меньше, чем в воде. Это обстоятельство служит, по-видимому, основной предпосылкой для достижения в условиях повышенных температур высокого выхода перекиси водорода. [30]
Страницы: 1 2 3 4