Распад - перекись - водород
Cтраница 3
Роль солей железа или других металлов переменной валентности состоит в ускорении распада перекиси водорода. [31]
Воспламенение топлив с перекисью водорода в качестве окислителя достигается применением катализаторов распада перекиси водорода. Высокая температура продуктов разложения перекиси водорода ( 400 - 500) обеспечивает воспламенение многих веществ, применяющихся в качестве горючего. В этом случае также могут применяться инициирующие вещества и катализаторы, способствующие воспламенению. [32]
При более высоких концентрациях Н202 ( до 18 М) выход реакции распада перекиси водорода составляет, как это было показано Дейнтоном [1, 2] 114 - 5400 атомов кислорода па 100 эв. [33]
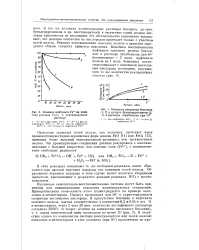 |
Кинетика окисления бензоина. [34] |
В этих реакциях возникают те же свободные радикалы, какие образуются при распаде перекиси водорода под влиянием солей железа. Образование перекиси водорода в этом случае может являться вторичным процессом, протекающим в результате реакции радикала НО а с восстановителем. [35]
Рейнольде [7], исследовавшие реакции гидрирования стирола, разложения муравьиной кислоты и метанола, распад перекиси водорода на железо-никелевых и медно-никелевых сплавах, установили, что каталитическая активность в случае первых трех реакций снижается параллельно заполнению rf - зоны. [36]
Это применение основано на свойстве ацетанилида быстро уничтожать свободные радикалы, которые катализируют реакцию распада перекиси водорода. Следы некоторых веществ, например соединений мышьяка, отравляют платиновый катализатор, используемый при окислении сернистого газа в серный ангидрид. Эти вещества закрывают активные места поверхности катализатора. Добавление окиси углерода уменьшает каталитическое действие метиленовой сини, а добавление кислоты - действие гидроксил-ионов. Слой краски действует как отрицательный катализатор, препятствующий гниению дерева. [37]
К этому типу реакций относятся реакции окисления аммиака на платине, двуокиси серы на платине и палладии, распад перекиси водорода на платине, декарбоксилирование виноградной кислоты на различных аминах и другие. [38]
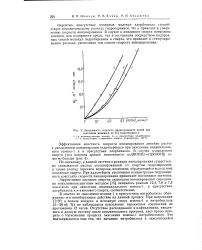 |
Зависимость скорости инициирования цепей при окислении нонена-1 от [ С ] гидропер киси. [39] |
По-видимому, в данной системе в реакции инициирования существенно сказывается распад ассоциированной со спиртом гидроперекиси, а также распад перекиси водорода, возможно, образующейся вследствие окисления спирта. При дальнейшем увеличении концентрации гидроперекиси константа скорости инициирования принимает постоянное значение. [40]
Из каталитических Процессов с участием кислорода на кристаллах платины с размером частиц 10 - 50 А в работе [2] изучен распад перекиси водорода, а в работе [17] - окисление спиртов и альдегидов. Катализаторы использовали тех же типов, что и для процессов гидрирования. Они были обез-гажены и оттренированы в тех же условиях, а затем различным образом окислялись на воздухе. [41]
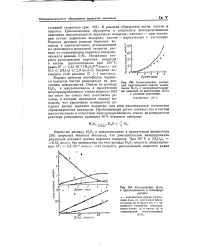 |
Расходование в циклогексаноле в атмосфере аргона. [42] |
Опыты по распаду Н202 в циклогексаноле в присутствии инициатора [56] ( перекиси бензола) показали, что дополнительное инициирование-радикалов ускоряет распад перекиси водорода. [43]
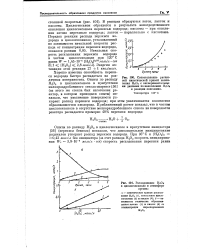 |
Сопоставление расчетной кинетической кривой накопления НаОа с экспериментальными данными по накоплению в реакции окисления.| Расходование в циклогексаноле в атмосфере-аргона. [44] |
Опыты по распаду Н202 в циклогексаноле в присутствии инициатора [56] ( перекиси бензола) показали, что дополнительное инициирование радикалов ускоряет распад перекиси водорода. [45]
Страницы: 1 2 3 4