Распад - эфир
Cтраница 2
Кроме этих веществ, в группе с двумя углеродными атомами в частице ожидается в некотором количестве этан как продукт распада эфира 1 всегда возникающего в процессе получения дивинила из спирта. [16]
Известно, что соли нитроалканов при взаимодействии с алкил-галогенидами по механизму нуклеофильного замещения образуют в случае С-алкилирования замещенные нитросоединения, а в случае О-алкилирования - карбонильные производные, получающиеся в результате распада промежуточных нитрониевых эфиров. Алкилирование солей нитроалканов галогеналкенами изучено в меньшей степени. [17]
Однако перегруппировка в р-положение никогда не сопровождается инверсией аллильной группы и для нее постерическим соображениям мало вероятно образование промежуточного циклического соединения. Это говорите пользу промежуточного распада эфира на ионы или радикалы. В свете этих данных следовало бы предполагать разные механизмы для о - и р-перегруп-пировок, но этому противоречит совершенно одинаковая их кинетика, вплоть до совпадающих величин энергии и энтропии активации. Последнее можно было бы согласовать с разными механизмами, лишь если предполагать для них одну и ту же наиболее медленную ступень, но трудно придумать такую общую ступень, которая в одном случае вела бы к внутримолекулярному превращению с инверсией аллильной группы, а в другом-к диссоциативному механизму. [18]
По видимому, и в других реакциях распада катализ осуществляется атомами J, хотя вопрос этот нельзя считать окончательно. Например, при распаде эфиров скорость реакции, невидимому, пропорциональна концентрации ( J2), а не J / ( J2), что представляет трудности для объяснения каталитического действия иода, как результат распада J2 на атомы. Для решения указанного вопроса нужны более тщательные исследования. [19]
По-видимому, и в других реакциях распада катализ осуществляется атомами J, хотя вопрос этот нельзя считать окончательно решенным. Например, при распаде эфиров скорость реакции, по-видимому, пропорциональна концентрации ( J2), а не V - ) что представляет трудности для объяснения каталитического действия иода, как результат распада J2 на атомы. Для решения указанного вопроса нужны дополнительные исследования. [20]
Однако перегруппировка в jo - положение никогда не сопровождается инверсией аллильной группы и для нее невозможно по стерическим соображениям предполагать образование промежуточного циклического соединения. Это говорит в пользу промежуточного распада эфира на ионы или радикалы. В свете этих данных следовало бы предполагать разные механизмы для о - и - перегруппировок, но этому противоречит совершенно одинаковая их кинетика, вплоть до совпадающих величин энергии и энтропии активации. Последнее можно было бы согласовать с разными механизмами, лишь если предполагать для них одну и ту же наиболее медленную ступень, но трудно придумать такую общую ступень, которая в одном случае вела бы к внутримолекулярному превращению с инверсией аллильной группы, а в другом - к диссоциативному механизму. Некоторые попытки разрешить все эти противоречия основывались на искусственных, неправдоподобных схемах и не заслуживают упоминания. [21]
Эта перегруппировка более типична для аллилфениловых эфиров, чем для бензилфениловых. Механизм возможно аналогичен механизму распада фенилциклогексилового эфира, который при нагревании дает о-циклогексилфенол, переходя через промежуточные стадии фенола и циклогексена. [22]
В ряду эфиров ароматических гидроксикислот гидроксиль-ная группа мало влияет на характер фрагментации, если она не находится в орто-положении к карбалкоксильной группе. Фрагментация таких эфиров аналогична распаду эфиров бензойной кислоты. [23]
Во всех случаях, за исключением н-пропилформиата, А имеет значения, обычные для мономолекулярного процесса; при распаде я-пропилформиата величина А меньше. Значение энергии активации для реакции распада н-пропилформиата также низко по сравнению со значениями Е для распада других первичных эфиров. Если это следствие ошибки на 5 или G ккал, допущенной при расчете энергии активации ( что вполне возможно, так как определение констант скоростей проводилось - олько при трех температурах), то пересчет величины А даст обычное для мономолекулярного процесса значение. [24]
Масс-спектры алкиловых эфиров алифатических тиоловых кислот RCOSR1 ( R CH3 - C8Hi7; R CHs - CUH23) содержат M различной интенсивности, которая уменьшается с увеличением длины группы R. В отличие от родственных эфиров кар-боновых кислот, которым свойственно образование ионов [ RCOOH2 ], при распаде эфиров RCOSR1 ионы [ RCOSH2 ] не возникают. Кроме того, тиоловым эфирам не свойственна перегруппировка Мак-Лафферти. Массовые числа пиков ионов [ RCOJ и [ R ] позволяют судить о природе кислотного остатка. [25]
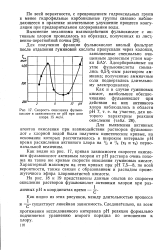 |
Скорость окисления фульвокислот в зависимости от рН при дозе хлора 15 мг / л. [26] |
Как видно из рис. 17, кривая зависимости скорости окисления фульвокислот активным хлором от рН раствора очень похожа на такие же кривые скорости окисления гуминовых кислот. Характерный максимум на этих кривых при рН 7 5 - 8, по всей вероятности, также связан с образованием и распадом промежуточного эфира хлорноватистой кислоты. [27]
Рассмотрение масс-спектра соединения I, полученного нами, свидетельствует о том, что начальная фрагментация пика М с m / z 372, обусловленная сужением макроцикла, происходит с малой вероятностью. При этом наряду с ожидаемым элиминированием группы С2Н4О и образованием ионов с m / z 328 осуществляется перегруппировочный процесс М - Н2О, отсутствующий при распаде ДБ-18-К-6. На схеме приведен предполагаемый механизм распада эфира I. Видно, что ион с m / z 310 фрагментирует по двум направлениям, связанным с расщеплением и ( или) сужением короны. Это направление является определяющим в масс-спектре соединения I. [28]
В некоторой степени это объясняется окислением эфира растворенным кислородом, однако в основном углекислота - продукт рас-пада эфира по алкил-кислородной связи. С учетом очень высокого общего выхода газообразных продуктов в опыте без кислорода можно заключить, что одной из основных реакций распада эфира в этих условиях является распад ацил-кислородной связи. [29]
Гомогенный катализ в газовой среде встречается сравнительно редко. В первую очередь следует упомянуть каталитическое действие водяных паров на горение СО, на разложение паров NH4C1 и на ряд других реакций, которые по мнению многих авторов вовсе не идут в случае, если газы очень тщательного высушены. Из других примеров заслуживают упоминания каталитическое действие NO2 или паров брома на образование хлористого нитрозила ( 2NO C12 2NOC1), ускорение распада простых предельных эфиров парами иода, йодистого метила, йодистого этила, камерное получение серной кислоты и пр. [30]
Страницы: 1 2 3