Распад - гидропероксид
Cтраница 2
Зависимость удельных скоростей распада гидропероксида 1 -метилцик-логексила и расхода ингибитора ( / [ ROOHJg) от начальной концентрации гидропероксида [39] показывает, что гомоассоциация гидропероксидов увеличивает их реакционную способность до определенного предела, выше которого дальнейшая агрегация в полимолекулярный ассоциат не приводит к большему снижению термостойкости гидропероксида. [16]
Помимо основной реакции распада гидропероксида, протекает ряд побочных процессов, приводящих к образованию ос-метилсти-рола и его димеров, кумилфенола, дифенилолпропана и оксида мезитила, а также некоторого количества ацетола, смол и незначительного количества других соединений. [17]
 |
Условия окисления алканов. [18] |
Направление вторичного процесса распада гидропероксида зависит от условий окисления: концентрации кислорода в окислительном газе, скорости газового потока ( времени пребывания продуктов в зоне окисления), наличия или отсутствия катализатора. В зависимости от этого, процесс окисления алканов идет или без разрыва углеродной цепи в сторону образования ВЭКС, или с разрывом цепи в сторону образования ВЖК. [19]
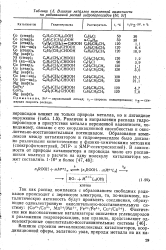 |
Влияние металлов переменной валентности на радикальный распад гидропероксидов. [20] |
Различие в направлении распада гидропероксидов в присутствии металла переменной валентности, по-видимому, связано с его координационной способностью и окислительно-восстановительным потенциалом. [21]
В условиях жидкофазного окисления распад гидропероксида идет так же по бимолекулярным реакциям, через стадию образования димера за счет водородной связи: образовавшийся димер распадается с большей скоростью, чем гидропероксид. [22]
Параллельно окислению СО происходит холостой распад используемого гидропероксида с образованием вода, трет. [23]
В первых исследованиях механизма распада гидропероксидов под действием металлсодержащих катализаторов было четко доказано гемолитическое направление такого распада. Распад ROOH под действием соединений железа, кобальта, марганца, меди инициирует цепные реакции радикальной полимеризации и окисления. Образование пероксидных радикалов в системе ROOH-соль тяжелого металла зафиксировано методом ЭПР. Под влиянием этих факторов сложилось представление, что ион ( комплекс) металла переменной валентности разрушает ROOH только гомолитически в результате одноэлектронного переноса. Однако в последние годы было показано, что часто протекают одновременно два процесса: гемолитический распад на радикалы и гетеролитический распад ROOH на молекулярные продукты, как это наблюдается и при распаде ROOH под действием кислот. [24]
Свободные радикалы появляются при распаде гидропероксидов, образующихся при окислении полимеров. Скорость окислительной деструкции зависит от строения полимеров. Так, полимеры, содержащие в цепи кратные связи, быстрее подвергаются деструкции, чем насыщенные. [25]
Предложены многочисленные схемы такого рода распада гидропероксидов, которые, к сожалению, не всегда хорошо обоснованы. [26]
Известно, что основными продуктами распада гидропероксида кумола являются пропанон-2 и фенол [2], а продуктом окисления 2-метилпропанола - 1 является 2-метилпропаналь, который далее окисляется до 2-метилпропионовой кислоты. Поэтому представляло интерес изучить влияние этих продуктов на реакцию эпоксидирования пентена-1 гидропероксидом кумола. [27]
Скорость эпоксидирования, конкурирующего с распадом гидропероксида, растет с увеличением числа электронодонорных заместителей при двойной связи и существенно снижается при наличии электроноакцепторных заместителей, например, винилхлорид не эпоксидируется в условиях, когда аллилхлорид, 1-хлорбутен - 1 и З - хлорбутен-1 легко превращаются в соответствующие оксиды. [28]
Во многом каталитический эффект при распаде гидропероксида в присутствии сульфидов обусловлен влиянием продуктов превращения исходного сульфида. [29]
С увеличением начальной концентрации гидропероксида возрастает распад гидропероксида и увеличивается степень окисления спиртов. Аналогичную закономерность можно наблюдать при увеличении концентрации катализатора, причем - 30 % распавшейся гидроперекиси расходуется на окисление спиртов. [30]
Страницы: 1 2 3 4 5