Гетерогенный распад
Cтраница 3
 |
Кинетика восстановления Fe2O3 водородом и образования Fe3C. [31] |
Скорость распада и состав продуктов, образующихся при пиролизе, в значительной степени зависит от особенностей условий распада углеводородных газов. По мнению [8], при низких концентрациях углеводородов их превращение на некаталитических поверхностях происходит путем прямого чисто гетерогенного распада на углерод и водород. С повышением концентрации углерода возрастает вероятность образования трехмерных зародышей в газовой фазе. После достижения некоторой пороговой концентрации начинается образование сажистого углерода в объеме. Заметный распад метана на металлическом железе начинается при 350 - 400 С. [32]
Результаты, полученные по распаду надкислоты в реакторах с насадкой, обработанных КС1 и борной кислотой и в отсутствие насадки, еще раз свидетельствуют о том, что действительно в отличие от принятых представлений распад надуксусной кислоты на поверхности протекает в основном по радикальному механизму. Концентрация радикалов, переходящих с поверхности в объем и накапливаемых в узле вымораживания, зависит как от скорости гетерогенного распада надуксусной кислоты, так и от скорости их гетерогенной рекомбинации. В случае реактора, обработанного KG1, большая часть перекиси распадается, но и больше радикалов гибнет. В случае реактора, обработанного борной кислотой, скорость гетерогенного распада надкислоты небольшая, но соответственно меньше и скорость гетерогенной рекомбинации радикалов. [33]
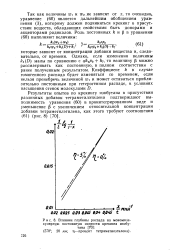 |
Влияние глубины распада на мономолекулярную постоянную скорости крекинга изобу. [34] |
Однако, если изменения величины йбф) малы по сравнению с а & 6ро &. Коэффициент / г в случае гомогенного распада будет изменяться со временем, если нельзя пренебречь величиной ы) и может оставаться приблизительно постоянным при гетерогенном распаде, в условиях насыщения стенок молекулами О. [35]
Адсорбированный на поверхности металла ингибитор окисляется гидропероксидом. При высокой концентрации ингибитора ( около 10 - 2 моль / л ионола и выше) этот процесс идет со скоростью, соизмеримой со скоростью гетерогенного распада гидропероксида на радикалы. [36]
Далее становится понятным, почему в условиях опытов [157] разложения метана при низких давлениях на нагретой углеродной нити при масспектрометрическом анализе промежуточных продуктов превращения не были обнаружены СНз - радикалы, но были найдены только СН2 - ради-калы. Понятно также, почему в опытах по изучению распада метана при помощи техники металлических зеркал [174] были найдены только метил-радикалы: в этих опытах не было условий для гетерогенного распада метил-радикалов. Результаты опытов [173] аналогичны [172], так как в этих исследованиях имел место быстрый распад СН3 - радикалов на углеродной нити и масспектрометрически обнаруживались только СН2 - радикалы. [37]
Окисление в жидкой фазе происходит значительно легче, чем газофазное окисление тех же веществ. Это, по-видимому, обусловлено большей концентрацией окисляемого вещества, значительным уменьшением скорости обрыва вследствие затруднения диффузии свободных радикалов к стенке, более благоприятными условиями для накопления гидроперекисей в силу уменьшения их гетерогенного распада. [38]
Окисление углеводородов в жидкой фазе протекает значительно легче, чем газофазное окисление тех же веществ. Это обусловлено, в частности, большей концентрацией окисляемого вещества, значительным уменьшением скорости обрыва цепи вследствие затруднения диффузии свободных радикалов к стенке, более благоприятными условиями для накопления гидроперекисей в силу уменьшения их гетерогенного распада. [39]
Указав на особенности жидкофазного окисления, отличающие его от окисления в газовой фазе ( большая концентрация окисляемого углеводорода, меньшая скорость обрыва цепей вследствие затрудненной диффузии радикалов к стенке сосуда, а главное - более благоприятные условия для накопления гидроперекисей ввиду трудностей их вовлечения в цепной процесс и уменьшения их гетерогенного распада), Семенов объяснил причины того, что окисление углеводородов в жидкой фазе всецело проходит через образование гидроперекисей. [40]
Расщепление метана может происходить в свободном объеме-гомогенно или на насадке ( катализаторе) - гетерогенно. Гомогенное разложение метана характеризуется образованием тонкодисперсного углерода, уносимого газовым потоком из зоны реакции. При гетерогенном распаде метана на поверхности контакта отлагается плотный слой углерода: Экспериментально показано [101], что температура гетерогенного разложения метана может быть на 150 - 200 С ниже, чем гомогенного разложения. [41]
Во втором случае энергия АС / становится положительной, и это влечет за собой повышение внутренней энергии. При этом каждый атом стремится окружить себя возможно большим числом атомов того же сорта. Это значит, что существует склонность к гетерогенному распаду. Если ДС / 0, то ни одна из возможных конфигураций не является предпочтительной. [42]
Результаты, полученные по распаду надкислоты в реакторах с насадкой, обработанных КС1 и борной кислотой и в отсутствие насадки, еще раз свидетельствуют о том, что действительно в отличие от принятых представлений распад надуксусной кислоты на поверхности протекает в основном по радикальному механизму. Концентрация радикалов, переходящих с поверхности в объем и накапливаемых в узле вымораживания, зависит как от скорости гетерогенного распада надуксусной кислоты, так и от скорости их гетерогенной рекомбинации. В случае реактора, обработанного KG1, большая часть перекиси распадается, но и больше радикалов гибнет. В случае реактора, обработанного борной кислотой, скорость гетерогенного распада надкислоты небольшая, но соответственно меньше и скорость гетерогенной рекомбинации радикалов. [43]
Исследуя параллельно изменение концентрации перекисных радикалов, поступающих в съемные реакторы, мы заметили следующую картину. С началом распада перекиси появляются новые перекисные радикалы, концентрация которых резко возрастает с повышением температуры. Кривые /, 2 и 3 представляют зависимости роста концентрации радикалов от температуры в реакторах, обработанных борной кислотой, не-обработанном и обработанном реакцией. Всюду опыт прерван при той температуре, прикоторойинтенсивность сигнала образующихся радикалов в 3 раза превышает исходную интенсивность. Эти опыты говорят о том, что по крайней мере до 22ГГ С образование перекисных радикалов в реакторах, обработанном КВг и необработанном, связано с гетерогенным распадом надуксусной кислоты, который сопров ождается образованием свободных радикалов, частично переходящих с поверхности в объем. [44]
Первое превращение происходит при температуре до 200 С. При низких температурах - до 100 С - скорость диффузии очень мала. При 20 С на этот же процесс потребуется около шести лет, а при 100 С всего лишь 50 мин. Поэтому до 80 С за время эксперимента практически никаких изменений в закаленном образце не наблюдается. В интервале температур от 80 до 150 - 200 С происходит так называемый двухфазный или гетерогенный распад мартенсита. При этих температурах в отдельных участках исходного мартенсита выделяются тончайшие пластины карбида. Толщина таких пластинок составляет несколько атомных слоев, длина - несколько сот ангстрем. Состав образовавшихся пластинок карбида окончательно не установлен. Известно, что он метастабилен, имеет гексагональную решетку. [45]
Страницы: 1 2 3