Термический распад - молекула
Cтраница 1
Термический распад молекулы по различным связям происходит со скоростью, определяемой энергией их разрыва. Поэтому величина энергии разрыва связи является фундаментальной характеристикой молекулы. [1]
Скорость термического распада молекул ( в особенности двухатомных) в значительной степени определяется скоростью возбуждения молекул до энергий, соответствующих их диссоциационному пределу. При высоких температурах, характерных для плазмохимических установок ( - 104 К), или при наличии легкоионизуемых добавок ( например, в МГД генераторах) из-за существенной степени ионизации в процессах возбуждения и распада молекул наряду с тяжелыми частицами заметную роль могут играть и электроны. Несмотря на это, в существующих теориях термической диссоциации роль электронного удара практически не рассматривается. [2]
Для термического распада молекул галоидов входящие в пред-экспоненциальный фактор А величины имеют следующие значения: эл / эл - 5, Аг; т 10, / вр / вр яз 5, так что А может превышать Z на два порядка. Для молекулы водорода плотность колебательных уровней мала ( Дг; 1), а эффект центробежного растяжения велик ( FBf I FBp ях 10), и А может на порядок превышать газокинетическое число столкновений. [3]
Детальные исследования термического распада молекул обычно проводят на сложных молекулах, содержащих большое число атомов. Слейтер пишет по этому поводу [1]: Мономолекулярные реакции первого порядка не типичны для небольших молекул, состоящих из двух, трех или четырех атомов; для осуществления этих реакций, вообще говоря, требуется более сложная структура молекулы или большее число атомов в молекуле. Распад больших молекул относительно легко изучать как прп низких, так и при высоких давлениях. Однако сравнительно мало что известно о физических свойствах этих молекул, об их механике. Часто известны основные частоты колебаний; намного хуже известно положение более высоких колебательных уровней и ангармоничность колебаний сложных молекул. Энергию разрыва [2] соответствующих связей обычно определяют на основании результатов измерения скорости мономолекулярного распада при высоких давлениях или на основании масс-спектрометрических исследований и поэтому ее значение всегда получается с ошибкой, часто значительной. [4]
Детальные исследования термического распада молекул обычно проводят на сложных молекулах, содержащих большое число атомов. Слейтер пишет по этому поводу [1]: Мономолекулярные реакции первого порядка не типичны для небольших молекул, состоящих из двух, трех или четырех атомов; для осуществления этих реакций, вообще говоря, требуется более сложная структура молекулы или большее число атомов в молекуле. Распад больших молекул относительно легко изучать как при низких, так и при высоких давлениях. Однако сравнительно мало что известно о физических свойствах этих молекул, об их механике. Часто известны основные частоты колебаний; намного хуже известно положение более высоких колебательных уровней и ангармоничность колебаний сложных молекул. Энергию разрыва [2] соответствующих связей обычно определяют на основании результатов измерения скорости мономолекулярного распада при высоких давлениях или на основании масс-спектрометрических исследований и поэтому ее значение всегда получается с ошибкой, часто значительной. [5]
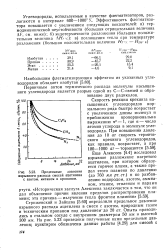 |
Предельные давления. [6] |
Первичным актом термического распада молекулы насыщенного углеводорода является разрыв одной из С-С - связей и образование двух радикалов. [7]
Было установлено, что термический распад молекулы может приводить к образованию свободных радикалов. [8]
Инициирование цепей в результате термического распада молекул на радикалы - процесс довольно трудный. Поэтому огромное значение для осуществления какой-либо цепной реакции имеет возможность тем или иным путем облегчить инициирование. [9]
Инициирование цепей в результате термического распада молекул на радикалы - прдцесс довольно трудный. Поэтому огромное значение для осуществления какой-либо цепной реакции имеет возможность тем или иным путем облегчить инициирование. [10]
Пренебрежение электронным ударом в теории термического распада молекул обусловлено в значительной мере тем, что основным инструментом для исследования термических процессов является ударная труба, где вследствие задержки ионизации процессы колебательной релаксации и диссоциации, по крайней мере при невысоких температурах, протекают в отсутствие заряженных частиц. Однако при больших скоростях ударных волн ( в азоте и воздухе при - 10 км / сек) эти процессы протекают частично при наличии значительных концентраций электронов. [11]
При интерпретации экспериментальных значений констант скоростей термического распада молекул или времени жизни колебательно-возбужденных ионов часто приходилось рассматривать s как эмпирический параметр, интерпретируемый как число эффективно участвующих во внутримолекулярном обмене энергии гармонических осцилляторов [7], причем оказывалось, что 5эфф составляет лишь некоторую долю от общего числа колебательных степеней свободы. Такое толкование приводит к весьма неопределенной физической картине обмена энергии, поскольку приходится предполагать, что связь некоторых осцилляторов с координатой реакции, отличная от нуля в принципе даже в гармоническом приближении, должна быть меньше ангармонической связи между активными осцилляторами, которая обеспечивает статистический характер распределения энергии между ними. ЭФФ связано с некорректным применением классической теории для интерпретации экспериментов, для которых условие применимости этой теории ( Hii kT - для термического распада и Е - Ео 5& JIMS - для распада ионов в масс-спектрометрических условиях) не выполняется. Оставаясь последовательно в рамках модели Касселя, невозможно выделить определенные колебательно-возбужденные конфигурации, которые можно было бы исключить из рассмотрения внутримолекулярного обмена энергии, поскольку такое исключение противоречило бы самой сущности модели. Однако если активированное состояние обладает определенной симметрией, то полные волновые функции колебательно-возбужденной молекулы, учитывающие ангармоническую связь между осцилляторами, но отвечающие различным типам симметрии, не могут смешаться в результате внутримолекулярных взаимодействий. Формально этот эффект может проявиться как уменьшение эффективного числа степеней свободы по сравнению с истинным. [12]
Наиболее простым способом инициирования реакции хлорирования является термический распад молекулы хлора на атомы. Обычно процесс термического хлорирования алкилароматических углеводородов осуществляется в газовой фазе, так как температура, при которой появляется достаточное для инициирования реакции количество атомов хлора, значительно выше температуры кипения хлорируемых углеводородов. [13]
В образовании атомарного кислорода значительно меньшую роль играет термический распад молекул кислорода. [14]
Было показано, что полимеризация стирола, инициированная термическим распадом молекул, способных образовывать свободные радикалы, имеет порядок 0 5 относительно концентрации этих молекул. [15]
Страницы: 1 2 3