Термический распад - гидроперекись
Cтраница 3
Следует отметить, что при комнатной и более низких температурах термический распад гидроперекиси тетрагидрофурана практически не происходит. [31]
 |
Скорость распада гидроперекисей в а-метилстироле при 85 С. [32] |
На основании полученных данных были рассчитаны константы А; скорости термического распада гидроперекисей по уравнению мономолекулярных реакций. Расчетные данные показали, что распад гидроперекисей удовлетворительно подчиняется уравнению реакции первого порядка. На основании тех же данных рассчитана энергия активации Е распада. [33]
Образование спиртов и кетонов в процессе окисления происходит за счет реакции термического распада гидроперекиси ( вырожденное разветвление) или распада, вызываемого металлами переменной валентности. [34]
Выход перекиси кумила как при окислении кумола, так и при термическом распаде гидроперекиси кумола сравнительно невысок. Соотношение выходов диметилфенилкарбинола и ацетофенона существенно отличается от полученных X. [35]
Показано, что в первом случае в смеси содержится большое количество продуктов термического распада гидроперекиси. [36]
Из сказанного можно сделать вывод, что температура оказывает исключительно большое влияние на направление термического распада гидроперекисей. [37]
Такой путь образования капроновой кислоты при окислении цнклогекгана подтверждается данными Притцкова и Мюллера М8 ], изучавшими термический распад гидроперекиси циклогексила. Среди продуктов распада было обнаружено некоторое количество капроновой кислоты. [38]
Она проходит медленнее, чем аналогичная реакция в водном растворе, но все же гораздо быстрее, чем термический распад гидроперекиси. [39]
Однако Фармер, Сундралингхам и Саттон [4, 13], исследуя окисление цикло-гексена при 40, установили, что основными первичными продуктами термического распада гидроперекиси являются соединения, содержащие гидрок-сильные и эпоксигруппы. [40]
При нарушении заданного режима температура может повыситься до 140 С и более, а это приведет к бурной самоускоряющейся реакции термического распада гидроперекиси изопропилбензола с большим выделением тепла. [41]
Такая реакция идет медленнее, чем шло бы взаимодействие иона Со с гидроперекисью, но несравненно быстрее, чем образование радикалов путем термического распада гидроперекиси в отсутствие кобальта. [42]
 |
Кинетические кривые изменения оптической плотности. [43] |
Такая реакция, по-видимому, протекает медленнее, чем аналогичная реакция в водном растворе, но все же гораздо быстрее, чем термический распад гидроперекиси. Быстрый распад гидроперекисей в углеводородных растворах в присутствии небольших количеств стеаратов или нафте-натов кобальта, марганца и железа хорошо известен, и сильное катализирующее действие этих солей на распад гидроперекисей не подлежит сомнению. Однако кинетика и механизм катализированного распада гидроперекисей в углеводородных растворах изучены слабо. [44]
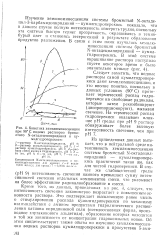 |
Кинетика хемилюминесценцйи при 90 С водных растворов бромистого N-октадецилпиридиния и ку-мил гидроперекиси. [45] |
Страницы: 1 2 3 4