Каталитический распад
Cтраница 1
Каталитический распад под влиянием алюмосиликатов при низких температурах, порядка 300, идет не так, как при пиролизе. Основное направление реакции состоит в перераспределении радикалов, причем из двух молекул замещенного бензола, и в меньшей степени - нафталина, получается одна молекула низшей степени замещения и одна - высшей степени замещения. [1]
Каталитический распад ацетилена осуществляется при температуре 700 С. При этом получается четыре основных типа углеродных структур: слой аморфного углерода, нити аморфного углерода, металлические частицы, заключенные в оболочку из графитовых слоев, и углеродные нанотрубки, покрытые снаружи аморфным углеродом. [2]
Каталитический распад перекиси водорода в водном растворе ускоряется многими ионами, например Cr O. Поскольку эта реакция является модельной для определения активности некоторых ферментов, в частности ката-лазы, она часто называется каталазным процессом. [3]
Подавляют каталитический распад гидропероксй-да кумола. [4]
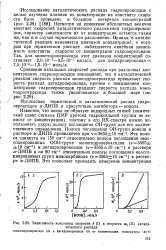 |
Зависимость константы скорости k ( I и скорости WQ ( II каталитического распада. [5] |
Исследован термический и каталитический распад гидропероксидов ж - ДИПБ в присутствии ингибитора - ионола. [6]
Механизм каталитического распада в адсорбцией ном слое, сопровождающегося эмиссией отрицательны. [7]
В результате каталитического распада таких смешанных сульфидов образуются тиофенол и непредельный углеводород, соответствующий радикалу R. В случае смешанных сульфидов нафталина наблюдаются совершенно, иные закономерности. Так, в результате контактирования с алюмосиликатным катализатором при 300 а-нафтилдецилсульфид распался на нафталин и децилмеркаптан, превратившийся в дальнейшем в децен и сероводород. Идентично, с образованием подобных же соединений, распадается и второй сульфид а-нафталинового ряда: а-нафтилциклопентилсульфид. В результате его распада получены нафталин и циклопентантиол, а из последнега как вторичные продукты - дициклопентилсульфид и сероводород. [8]
Поскольку при каталитическом распаде гидроперекисей образуются радикалы RO и RO2, являющиеся носителями кинетических цепей окисления, появление феноксильных радикалов в таких моделирующих окисление системах [14] свидетельствует об отрыве гидроксильного водорода фенола активными радикалами как о первичном элементарном акте ингибирования, причем реакционная способность ОН-связи в феноле является одной из важнейших характеристик эффективности фенола как ингибитора. [9]
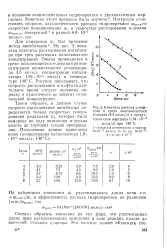 |
Кинетика расхода а-нафтола в среде окисляющегося н-декана ( 4 5 моль / л в присутствии соли марганца ( 1 84 10 - 3. [10] |
Интересно сопоставить скорость каталитического распада гидроперекиси wpacnco скоростью инициирования W; и скоростью расходования н-декана окисл. [11]
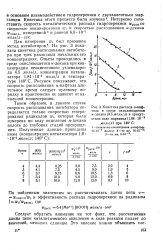 |
Кинетика расхода а-нафтола в среде окисляющегося н-декана ( 4 5 моль / л в присутствии соли марганца ( 1 84 10 - 3. [12] |
Интересно сопоставить скорость каталитического распада гидроперекиси Шраспсо скоростью инициирования Ш; и скоростью расходования н-декана Шокисл. [13]
Энергия активации реакции каталитического распада гипохлорита натрия / / Журн. [14]
Щелочная среда способствует каталитическому распаду перекиси водорода. Напротив, кислая среда его затрудняет. Поэтому раствор r Oj часто подкисляют серной кислотой. Разложение перекиси водорода идет быстрее при нагревании и на свету, поэтому хранить ее следует в темном прохладном месте. [15]
Страницы: 1 2 3 4