Каталитический распад
Cтраница 3
Причинами снижения селективности реакции эпоксидирования являются побочная реакция каталитического распада гидропероксида и влияние продуктов распада на активность и избирательность катализатора. [31]
Спирты в реакции эпоксидирования проявляют себя как ингибиторы каталитического распада гидропероксида, а также как активаторы и ингибиторы эпоксидирования олефинов. [32]
Поскольку известно [5], что вольфрамат-ион WO42 - ускоряет каталитический распад перекиси водорода в водном растворе, то на основании теории гомогенного катализа можно считать, что между вольфрамат-ионом и перекисью водорода образуется ре-акционноспособный и неустойчивый активный комплекс. Такой комплекс относительно медленно распадается с образованием продуктов реакции и регенерацией вольфрамат-иона. В КПЗ электронное облако перок-согруппы смещено к вольфраму и вблизи катода может под действием поляризации произойти насыщение пероксогруппы электронами с дальнейшей передачей электрона по пероксоцепочке к иону вольфрама. [33]
Медь ( II) понижает результаты вследствие вызываемого ею каталитического распада диазотированной сульфаниловой кислоты. В присутствии меди пробу также разбавляют. [34]
Одно из характерных свойств перекиси водорода - способность к каталитическому распаду, который протекает в присутствии катализаторов с очень большой скоростью и с выделением значительного количества тепла. [35]
Представляется интересным выяснить влияние кислотности раствора ( рН) на скорость каталитического распада пероксида водорода. [36]
Значительно более разнообразны реакции перекисей с расщеплением О-О - связи, сопровождающим обычный термический и каталитический распад перекисей. С разрывбм О - - О-связи протекают и реакции со многими органическими соединениями, причем эти процессы в большинстве случаев протекают по свободноради-кальному механизму. [37]
Значительно более разнообразны реакции перекисей с расщеплением О - О-связи, сопровождающим обычный термический и каталитический распад перекисей. С разрывом О - О-связи протекают и реакции со многими органическими соединениями, причем эти процессы в большинстве случаев протекают по свободноради-кальному механизму. [38]
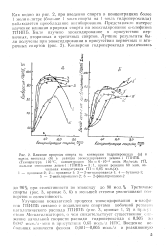
Улучшение показателей процесса эпоксидирования а-олефи-пов ГПИПБ связано с подавлением спиртами побочной реакции каталитического распада ГПИПБ ( рис. 3, кривые 1, 2) в при; у г ствнн Mo-катализаторов, о чем свидетельствует существенное снижение начальной скорости распада гидропероксида с 0 305 до 0 047 моль / л-мин в присутствии 0 65 моль / л ИПС. [40]
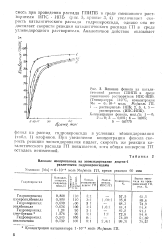 |
Влияние фенола на каталитический распад ГПИПБ в среде смешанного растворителя ИПС-ЙПБ, ( Температура 110 С, концентрация Мо 6. 10 - 4 моль Mo / моль ГП, 1 - растворитель ИПБ. 2, 3, 4, 5. [41] |
При увеличении концентрации фенола скорость реакции эпоксидирования падает, скорость же реакции каталитического распада ГП повышается, хотя общая конверсия ГП осталась неизменной. [42]
Известно [5], что спирты в реакции эпоксидирования проявляют себя как ингибиторы каталитического распада гидропероксида, а также как активаторы и ингибиторы эпоксидирования алкенов. В изученном интервале концентраций 2-метилбутанол - 2 ( см. табл. 1) проявляет ингибирую-щую функцию. [43]
Не менее интересными должны быть сведения о влиянии ионной силы раствора на скорость каталитического распада пероксида водорода. [44]
Образование высших окислов, повидимому, играет такую же роль при так называемом каталитическом распаде, как и при нормальном разложении перекиси водорода. [45]
Страницы: 1 2 3 4