Фотохимический распад
Cтраница 3
Если реакция образования свободных радикалов с малой продолжительностью жизни за счет, скажем, фотохимического распада протекает в растворе, то образовавшиеся радикалы будут столь тесно окружены растворителем, что они либо быстро рекомбинируют-ся друг с другом в результате дезактивирующих столкновений с мо-лекул ами растворителя, либо распадутся или же прореагируют с молекулами растворителя. На практике оказывается, что чаще всего реакция приводит именно к взаимодействию с растворителем. Возможна также реакция и с каким-либо другим растворенным веществом, однако в случае разбавленных растворов она мало вероятна. [31]
Для таких веществ, как, например, азид бария, которые могут подвергаться фотохимическому распаду, предварительное облучение ультрафиолетовым светом [7,8] также сокращает период индукции. [32]
Исчерпывающему рассмотрению нитренов, которые часто выступают в роли промежуточных соединений, образующихся при фотохимическом распаде азидов, посвящен разд. Обычно при раскрытии цикла в азиридинах образуется также некоторое количество диамина. [33]
Известно, что свободные метиленовые радикалы, получающиеся в объеме, например при термическом или фотохимическом распаде диазомета-на, достаточно реакционноспособны, хотя по некоторым данным [9] они имеют скорее природу молекул, чем свободных радикалов, так как содержат двухвалентный углерод и не обладают непарными электронами. Метиленовые же радикалы, образовавшиеся на катализаторе, по-видимому, представляют собой активную форму с четырехвалентным углеродным атомом, причем большая активность обусловлена либо большим напряжением, вызванным двойной связью с катализатором, либо свободной валентностью. Поэтому можно полагать, что СН2 - радикалы на поверхности по своей реакционноспособности не только не уступают, но даже превосходят СШ-радикалы в объеме, а также активнее поверхностных атомов Н или любого другого свободного атома или радикала, обладающего одной свободной валентностью и потратившего ее в той или другой степени на связь с гетерогенным катализатором. [34]
Окись азота является широко известным ингибитором цепных реакций и свободных радикалов и индикатором на них при термическом и фотохимическом распаде органических соединений. [35]
Перекисно-ураниловый актинометр практически не изменяется при использовании, так как нужно заменять только перекись водорода, израсходованную вследствие фотохимического распада. После длительной работы раствор доводят до исходного объема отгонкой воды. Восстановления UVI в UIV не происходит. Если, согласно Гейдту [24], UVI восстанавливается в UIV, то последний снова превращается в UVI, реагируя с Н2О2, и общий баланс процесса не нарушается. [36]
Найдено, что скорость поглощения Ог при окислении метилметакрилата, инициированном термическим распадом динитри-ла азоизомасляной кислоты при 50 С или его фотохимическим распадом при 20 С в массе или циклогексане, имеет первый порядок относительно концентрации мономера и порядок, равный 0 5, относительно концентрации инициатора. [37]
Скорость поглощения кислорода при окислении метилметакрилата, инициированном термическим распадом динитрила азоизомасляной кислоты при 50 С ( концентрация 0 00125 - 0 005 М) или его фотохимическим распадом при 20 С ( концентрация 0 01 - 0 08 М) в массе и растворах циклогексана, имеет первый порядок относительно концентрации мономера и порядок, равный половине, относительно концентрации инициатора. [38]
 |
Спектры ЯМР бензильных протонов молекул 1, 1 2. [39] |
Радикальная пара [ Ph CH H2CPh ] образуется тремя способами ( см. схему): а) фотолиз дифенилдиазометана в толуоле с генерацией дифенилкарбена, основное состояние которого является триплетным; последующая реакция триплетного карбена с толуолом рождает триплетную радикальную пару; б) термический или фотохимический распад азосоединения происходит в синглетном состоянии и рождает синглетную радикальную пару; в) наконец, при термическом распаде перекиси бензоила в смеси толуола и ди-фенил-метана бензоилокси-радикалы реагируют с молекулами растворителя, рождая радикалы PhCH2 - и Ph2CH; последующие их случайные диффузионные встречи рождают радикальные пары с некоррелированными спинами. [40]
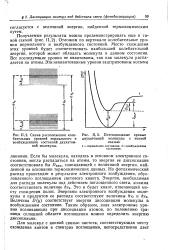 |
Схема расположении колебательных уровней нормального и возбужденного состояний двухатомной молекулы.| Потенциальные кривые. [41] |
Но фотохимический распад происходит в результате электронного возбуждения, обусловленного поглощением светового кванта. [42]
Циклопентанон может подвергаться фотохимическому распаду, давая с хорошим выходом циклобутан ( Кистяковский. [43]
Кроме кинетических, имеются также и химические данные, подтверждающие, что в основе фотохимической активации лежит процесс расщепления электронных пар. Например, при фотохимическом распаде йодистого метила получается 35 % - ный выход этана [6], который едва ли мог бы получиться в результате ионного распада, если только при этом не образуются одновременно положительные и отрицательные алкил-ионы, что, конечно, крайне мало вероятно. [44]
Фотохимический распад молекулы происходит после некоторого времени жизни Т; в дискретном состоянии. Связь между диффузностью и фотохимическим распадом была впервые установлена Бонхеффером и Фаркашем [129], которые показали, что фотораспад NH3, возникающий при поглощении света в области диффузных полос около 2100 А ( фиг. [45]
Страницы: 1 2 3 4