Расположение - атом - углерод
Cтраница 1
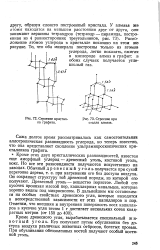 |
Строение кристалла графита.| Строение кри сталла алмаза. [1] |
Расположение атомов углерода в кристалле показано на этом жв рисунке. [2]
Расположение атомов углерода в углах правильных шестиугольников вызывает естественное предположение о равноценности трех связей атома с тремя ближайшими соседями. Один s - электрон и два р-элек-трона, смешиваясь, участвуют в образовании трех равноценных сигма-связей между атомами углерода в слое. Состояния смешанных трех электронов описываются гибридными волновыми функциями. Облака вероятности указанных электронов, имеющие вид несимметричных гантелей, расположены в одной плоскости и направлены под углом в 120 друг к другу. [3]
 |
Строение кристалла графита.| Строение кристалла алмаза. [4] |
Расположение атомов углерода в кристалле показано на этом же рисунке. То, что оба минерала построены только из атомов углерода, легко показать, сжигая в кислороде алмаз и графит: в обоих случаях получается углекислый газ. [5]
Однако расположение атомов углерода в смежных плоских сетках не является симметричным: шестиугольники сдвинуты друг относительно друга так, что лишь каждый второй атом углерода имеет соответственные атомы углерода под собой и над собой, все же остальные атомы расположены против центров шестиугольников в смежных сетках. [6]
Итак, расположение атомов углерода в графите характеризуется менее плотной упаковкой, чем в алмазе. [7]
Для алмаза характерно трехмерное расположение атомов углерода в пространстве, на равном расстоянии друг от друга, все атомы связаны ковалентными связями. Алмаз не поглощает свет и отличается большой твердостью. Сетки расположены слоями одна над другой, причем их связь менее прочная ( расстояние между ними 3 3 А), поэтому легко расщепляются. Фуллерен известен только с 1990 г. Он представляет собой полые образования типа футбольного мяча или мяча для регби, соответстенно Cgo и Суо - Структурные элементы фуллеренов подобны таковым графита, только плоская гексагональная сетка последнего свернута и сшита в замкнутую сферу или сфероид, при этом часть шестиугольников преобразуется в пятиугольники. В силу полого строения молекул фуллерен обладает небольшой плотностью ( 1 7 г / см3), что значительно ниже, чем у графита и тем более алмаза. Перспектива использования фуллеренов разнообразна - аккумуляторные батареи, полупроводники, сырье для получения алмазов, основа для запоминающей среды со сверхвысокой плотностью информации. [8]
При таком расположении атомов углерода - каждый из них - находится в центре тетраэдра. От дюбога атома идут четыре связи под углом ( 109 28), характерным для насыщенных соединений четырехвалентного углерода. Таким образом кристалл в делом является как бы гигантской молекулой, где все атомы соединены направленными связями, энергия которых, как и расстояние между соседями, близки к таковым для одинарной связи в насыщенных углеводородах. [9]
Если молекулы различаются расположением атомов углерода, образующих их каркас, то говорят об изомерии скелета. [10]
Изомерия нафтеновых кислот определяется именно расположением атомов углерода в боковых цепях ядра. [11]
Рассказывают, будто мысль о расположении атомов углерода в бензольном кольце химику Кекуле пришла в голову, когда он был слегка навеселе. [12]
 |
Совмещение кристаллографических плоскостей ( 111 Fe -, ( 110 FeQ. [13] |
На рисунке крестиками показаны возможные места расположения атома углерода. Чем больше углерода было в аустените, тем большее число элементарных ячеек мартенсита будет содержать атом углерода и тем большими окажутся средние искажения пространственной решетки. [14]
С повышением температуры дальний порядок в расположении атомов углерода должен был бы исчезнуть. [15]
Страницы: 1 2 3 4