Расположение - атом - углерод
Cтраница 3
При таком расположении атомов углерода можно построить модели циклических соединений с числом членов, равным шести и более, без деформации валентных углов атома углерода. Однако впоследствии при определении теплот сгорания цик-ланов было установлено, что минимальной теплотой сгорания на группу - СН2 - обладает циклогексан. С увеличением или уменьшением числа членов в цикле теплота сгорания на группу - СН2 - возрастает. Соответственно изменяется и напряженность цикла, так как разность теплот сгорания циклического соединения и соответствующего ему соединения с открытой цепью является мерой напряженности циклов. [31]
При таком расположении атомов углерода можно построить модели циклических соединений с числом членов, равным шести и более, без деформации валентных углов атома углерода. Однако впоследствии, при определении теплот сгорания цикланов, было установлено, что минимальной теплотой сгорания на группу СН2 обладает циклогексан. С увеличением или уменьшением числа членов в цикле теплота сгорания на группу СН2 возрастает. Соответственно изменяется и напряженность цикла, так как разность теплот сгорания циклического соединения и соответствующего ему соединения с открытой цепью является мерой напряженности циклов. [32]
Саксе и Мор высказали представление о неплоско ст-н о м строении циклов с числом членов больше пяти. При таком расположении атомов углерода можно построить модели циклических соединений с числом членов, равным шести и более, без деформации валентных углов атома углерода. [33]
Расстояние между ближайшими плоскостями равно 3 345 А, а между симметрично расположенными - 6 69 А. При таком сдвинутом расположении атомов углерода в соседних сетках достигается очень плотная упаковка их в графите. Даже при воздействии высоких давлений ( 8 000 - 10 000 кПсм1) межслоевое расстояние сокращается лишь на 0 014 А за счет деформации сферической поверхности атомов углерода, что характерно для графита, имеющего малый коэффициент сжатия. [34]
В данном случае она должна быть значительно более сложной, так как каждый атом иода сжат в плоскости молекулы в двух взаимноперпендикулярных направлениях. Так как возможны два варианта расположения атомов углерода ( связь С С может располагаться вдоль любой средней линии квадрата), определить размер атома в данном направлении в зависимости от наклона его к валентной связи нельзя. Кроме того, эта зависимость и не была бы в данном случае однозначной, так как из-за понижения симметрии атома направление связи перестает быть особой линией. Размер атома следует характеризовать в зависимости от двух углов: а и Р; а соответствует наклону рассматриваемого направления к плоскости молекулы, р - угол между проекцией этого направления на плоскость молекулы и ее диагональю. [35]
Четыре атома азота МЦЛ лежат в одной плоскости, из которой атом никеля смещен на 0ЗЗА в сторону азидного лиганда. Авторы объясняют эту аномалию неупорядоченностью в расположении атомов углерода этих циклов, что подтверждается повышенными значениями их температурных факторов. Для Ni ( N-TMC) получены также азидные комплексы с цинком и медью. Все они сохраняют пирамидальную координацию как в твердом состоянии, так и в растворах. [36]
 |
Структурная модель перепутанных лент стеклоуглерода. [37] |
В строго кристаллографическом понимании пакеты по структуре нельзя отнести к кристаллам, так как в них отсутствует трехмерная упорядоченность. В каждой плоскости пакета имеется строгий порядок расположения атомов углерода, поэтому пакеты являются как бы двухмерными кристаллами. Однако условно в литературе принято турбостратную структуру углерода называть кристаллической, что с практической точки зрения вполне оправдано. [38]
Алмаз является одной из многочисленных модификаций углерода, которые отличаются между собой определенным расположением атомов в кристаллической решетке. Посредством применения высокой температуры и большого давления добиваются такого расположения атомов углерода ( например, графита), которое является характерным для алмаза. Самые крупные кристаллы, какие удалось в настоящее время получить, составляют не более одной десятой карата. Помимо величины кристалла, искусственные алмазы отличаются от естественных большей шероховатостью, повышенной хрупкостью, менее правильным строением. Они представляют собой как бы технический сорт ( борт) естественных алмазов и могут быть использованы только в качестве сырья для шлифовальных кругов. Это имеет важное значение, если учесть необходимость применения для кругов только мелких кристаллов, получаемых путем раздробления, а также огромный расход алмазов на изготовление кругов. [39]
Таким образом, адамантан представляет собой комбинацию из четырех сконденсированных циклогексановых колец в форме кресла. Расположение углеродных атомов в его молекуле почти точно повторяет расположение атомов углерода в кристаллической решетке алмаза. [40]
Таким образом, адамантам представляет собой комбинацию из четырех сконденсированных циклогексановых колец в форме кресла. Расположение углеродных атомов в его молекуле почти точно повторяет расположение атомов углерода в кристаллической решетке алмаза. [41]
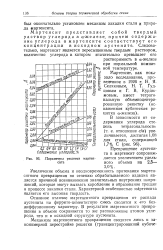 |
Параметры решетки мартенсита. [42] |
Основное отличие мартенситного превращения от распада аустенита на феррито-цементитную смесь сводится к его без-диффузионно. В результате мартенситного превращения в объеме сохраняется то же расположение атомов углерода, что и в исходной структуре аустенита. [43]
Цепочка соединенных друг с другом атомов углерода может быть прямой ( открытой) или разветвленной. В молекулах этана и пропана возможен только один вариант расположения атомов углерода. Их структурные формулы могут быть представлены только в виде прямой неразветвленной цепочки. Подобные углеводороды с прямой цепочкой называются нормальными. Начиная с бутана, члены метанового ряда могут иметь как нормальную, так и разветвленную цепочку. Углеводороды с разветвленной цепочкой являются изомерами ( греч. [44]
МО, исходя из моделей, рассматривающих необычное ( или неклассическое) расположение атомов углерода и водорода. При таком подходе ион 5.15 рассматривается как слегка отклоняющийся от нормы аллил-катион, в результате чего приходят к заключению, что 1 3-взаимодейст-вие снижает энергию системы. [45]
Страницы: 1 2 3 4