Расположение - уровни - энергия
Cтраница 1
Расположение уровней энергии в этом случае совершенно другое. [1]
Порядок расположения уровней энергии при электронной конфигурации определяется путем решения уравнений Хартри-Фока, а также на основании анализа корреляции электронов, о чем пойдет речь дальше. [2]
Поэтому можно представить себе расположение уровней энергии молекулы, подобное показанному на рис. VI. Одному электронному уровню молекулы соответствует много колебательных уровней, а каждому колебательному уровню - много вращательных. [3]
 |
Схема расщепления энергетических у ров не и изоли-р ов а н ногю иона неодима при комнатной температуре 300 К. [4] |
Основное влияние на место расположения уровней энергии оказывает наиболее сильное кулоновское взаимодействие электронов с ядром и друг с другом. [5]
Обсудим теперь общие закономерности расположения уровней энергий атома. Если электроны находятся в состоянии с определенными числами п и I ( говорят, что в таких случая задана электронная конфигурация), то такому распределению может соответствовать несколько различных энергетических уровней, различающихся как полным орбитальным моментом, так и полным спином системы. [6]
Такое же соответствие в расположении уровней энергии имеется в ряду Li, Ве, В2, С3, из чего следует заключить, что остов атома углерода, если не говорить о ядре, соответствует остову атома гелия. Сравнивая схемы уровней, приведенные на рис. 70 и 71, можно заключить, что у алюминия третий присоединяющийся к остову атома А13 электрон связан иначе, чем два электрона, присоединившиеся до него. Из правой половины рис. 71 видно, что у ионизированного углерода С валентный электрон находится в нормальном состоянии на 2 р-уровне. Электронное облако, символизирующее вероятность его нахождения вблизи ядра, имеет не симметрию шара, которой обладают электронные облака двух электронов, присоединяющихся после образования гелиевой оболочки, а только симметрию вращения. Четвертый внешний электрон, по спектральным данным, также находится на 2р - уровне. Таким образом, из четырех внешних электронов нейтрального атома С два находятся на 2р - уровио и два - на 2-уровне. Два последних электрона обладают антипараллельными спинами. Энергетические уровни внешних электронов, аналогичные уровням углерода, определяются из спектральных термов для кремния: два электрона па 3s - и два электрона на Зр-уровне; это же справедливо и для других аналогов углерода, которые, следовательно, в противоположность элементам побочной подгруппы IV группы не только химически, но и спектроскопически аналогичны обоим наиболее легким элементам главной подгруппы. [7]
Такое же соответствие в расположении уровней энергии имеется в ряду Li, Ве, В2, С3, из чего следует заключить, что остов атома углерода, если не говорить о ядре, соответствует остову атома гелия. Сравнивая схемы уровней, приведенные на рис. 70 и 71, можно заключить, что у алюминия третий присоединяющийся к остову атома А13 электрон связан иначе, чем два электрона, присоединившиеся до него. Из правой половины рис. 71 видно, что у ионизированного углерода С валентный электрон находится в нормальном состоянии на 2 / - уровне. Электронное облако, символизирующее вероятность его нахождения вблизи ядра, имеет не симметрию шара, которой обладают электронные облака двух электронов, присоединяющихся после образования гелиевой оболочки, а только симметрию вращения. Четвертый внешний электрон, по спектральным данным, также находится на 2 / - уровне. Таким образом, из четырех внешних электронов нейтрального атома С два находятся на 2 / - уровне и два - на - уровне. Два последних электрона обладают антипараллельными спинами. Энергетические уровни внешних электронов, аналогичные уровням углерода, определяются из спектральных термов для кремния: два электрона на 3s - и два электрона на З / - уров-не; это же справедливо и для других аналогов углерода, которые, следовательно, в противоположность элементам побочной подгруппы IV группы не только химически, но и спектроскопически аналогичны обоим наиболее легким элементам главной подгруппы. [8]
На рис. 104 представлена схема расположения уровней энергии в металле и полупроводнике при условии, что за начало отсчета энергии принята энергия электрона, покоящегося в вакууме. [9]
Допустим, что имеет место такое расположение уровней энергии динамической системы, при котором соотношение ( Ofcm ( о г г О выполняется только в одном из двух следующих случаев. [10]
 |
Ориентация спина SB, относительно выбран. [11] |
На рис. 3.6, б схематично показано расположение уровней энергии, отвечающее этому случаю. На этом рисунке пропорции не соблюдены. [12]
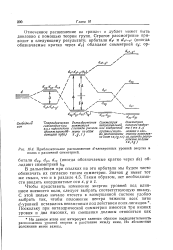 |
Приблизительное расположение rf - электронных уровней энергии в полях с различной симметрией. [13] |
На данном этапе нас интересуют главным образом последовательность расположения уровней энергии и расстояние между ними. [14]
Соотношение ( 38 15) определяет, очевидно, расположение Уровней энергии системы. [15]
Страницы: 1 2 3 4