Расположение - уровни - энергия
Cтраница 3
Имеется другая трудность в объяснении механизма электронного обмена, которая является более серьезной и будет рассмотрена детально. В то время как для механизма передачи энергии расположение уровней энергии молекулы красителя относительно уровней полупроводника не является существенным, передача электрона может происходить только при определенном взаимном их расположении. [31]
Коулсон и Рашбрук [43] показали, что такой тип симметричного расщепления всегда наблюдается для ненасыщенных и ароматических соединений, не содержащих нечетных колец и называемых альтернантными ароматическими соединениями. С другой стороны, при образовании вышеописанным образом азулена эта симметрия в расположении уровней энергии утрачивается, что обусловлено не более низкой симметрией соединения, а наличием нечетных циклов. Введение трех новых связей в 18-членное кольцо с образованием 1 2-бензантрацена, не имеющего плоскости симметрии, но состоящего только из четных циклов, приводит к симметричному расщеплению, подобному тому, которое имеет место в нафталине. Такие соединения называются неальтернантными. Строго говоря, такая классификация применима только к соединениям, все атомные орбиты % г которых, участвующие в тг-элек-тронной системе, могут считаться одинаковыми, например к ароматическим углеводородам. [32]
Коулсоп и Рашбрук [43] показали, что такой тип симметричного расщепления всегда наблюдается для ненасыщенных и ароматических соединений, не содержащих нечетных колец и называемых альтернантными ароматическими соединениями. С другой стороны, при образовании вышеописанным образом азулена эта симметрия в расположении уровней энергии утрачивается, что обусловлено не более низкой симметрией соединения, я наличием нечетных циклов. Введение трех новых связей в 18-членное кольцо с образованием 1 2-бензантрацена, не имеющего плоскости симметрии, но состоящего только из четных циклов, приводит к симметричному расщеплению, подобному тому, которое имеет место в нафталине. Такие соединения называются неальтернантными. Строго говоря, такая классификация применима только к соединениям, все атомные орбиты у-г которых, участвующие в тг-элек-тронной системе, могут считаться одинаковыми, например к аро-м этическим углеводородам. [33]
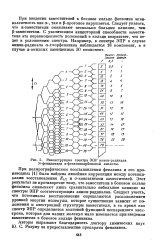 |
Реконструкция спектра ЭПР анион-радикала N-фениламида а-феназинкарбоновой кислоты. [34] |
При полярографическом восстановлении феназина и его производных [1 ] была найдена линейная корреляция между потенциалами восстановления Z. Этот результат не противоречит тому, что заместители в боковом кольце феназина оказывают лишь сравнительно небольшое влияние на спектры ЭПР соответствующих анион-радикалов. Следует учесть, что потенциалы восстановления определяются расположением уровней энергии молекулы, которое существенно зависит от положения и электронной структуры заместителя, в то время как спектр ЭПР определяется волновой функцией неспаренного электрона, которая для наших молекул мало изменяется при введении ваместителя в боковое кольцо феназина. [35]
 |
Простой метод получения энергий я-орбиталей хюккелевских и ме-биусовских циклических систем ( согласно работе. [36] |
Согласно Дьюару [28, 45], устойчивые переходные состояния могут рассматриваться как ароматические, а неустойчивые - как антиароматическйе. Это следует из определения, что ароматичность и антиароматичность в циклическом соединении может определяться как большая или меньшая устойчивость по сравнению с устойчивостью соответствующего нециклического соединения. Правила устойчивости по Хюккелю и Мебиусу следуют просто из расположения уровней энергии МО в приближении Хюккеля. [37]
В методе Мессбауэра определяют интенсивность у-излучения, прошедшего через образец при изменении скорости движения источника или образца. По полученным данным строят кривую зависимости интенсивности поглощения от скорости движения, которая и является мессбауэровским спектром. Скорость движения образца или источника, необходимая для достижения резонансных условий, зависит от различия в расположении уровней энергии ядер источника и образца, которое в свою очередь определяется природой и взаимодействием между ядрами и их химическим окружением. Это и есть основа применения эффекта Мессбауэра в химии. Сдвиг линий в спектре и ( или) их расщепление указывают на изменения окружения ядер. Результаты экспериментов фиксируют значение изомерного сдвига 6, квадрупольного расщепления и эффекта Зеема-на - сверхтонкого расщепления линий при наложении внешнего магнитного поля. Наличие изомерного сдвига линий объясняется тем, что расположение ядерных уровней энергии ( а значит, и резонансная энергия у-квантов Еу) очень чувствительно к изменению химического окружения ядер. [38]
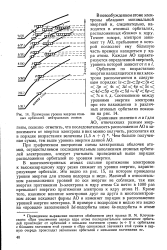 |
Примерные уровни энергии атомных орбиталей нейтральных атомов. [39] |
В многоэлектронных атомах сильное притяжение электронов к высокозарядному ядру резко снижает их уровни энергии, характеризующие орбитали. Это видно из рис. 15, на котором приведены уровни энергии для атомов водорода и меди. Кроме того, взаимное влияние электронов друг на друга в многоэлектронном атоме искажает формы АО и изменяет порядок в расположении уровней энергии электрона. [40]
Второе обстоятельство, резко отличающее процесс неупругого соударения положительного нона от такого же соударения электрона, заключается в том, что при одном и том же запасе кинетической энергии скорость электрона вследствие малости его массы во много раз больше скорости положительного иона. Поэтому быстрый электрон за то время, в течение которого он передает долю своей энергии нейтральной частице газа, успевает удалиться, и избыток энергии, приобретенный нейтральной частицей, неизбежно ведет к изменению ее энергетического состояния. Наоборот, вследствие гораздо меньшей скорости положительного иона его электроны, а также электроны, входящие в состав частицы, с которой ион соударяется, совершают большое число оборотов вокруг соответствующего ядра, или, другими Словами, и нейтральная частица и ион подвергаются воздействию лишь медленно изменяющегося электрического поля, оказывающего значительное воздействие на расположение уровней энергии электронов как в частице, так и в ионе. [41]
Когда два атома сближаются настолько, что их орбиты перекрываются, орбиты с одинаковыми энергиями комбинируются с образованием двух объединенных орбит, одна из которых имеет более высокую энергию, а вторая - более низкую ( см. стр. При присоединении еще двух атомов такого же типа образуются еще две объединенные орбиты с дальнейшим расщеплением энергий. Присоединение дополнительных атомов с перекрывающимися орбитами приводит к расположению уровней энергии, изображенному на рис. 65 ( см. обсуждение я-орбит в бензоле на стр. [42]
 |
Расщепление энергетического уровня, обусловленное-взаимодействием Sd-орбиталей центрального иона с 2 / 7-орбита-лями лиганда. [43] |
Поскольку перекрывание для молекулярных орбиталей 0-типа намного сильнее, чем для орбита-лей я-типа, следует ожидать, что в первом случае энергия взаимодействия должна быть значительно больше. На рис. 12 - 17 показано предполагаемое расположение уровней энергии для этого простого случая. Лиганд-ные электроны заполняют связывающие молекулярные орбитали. Две разрыхляющие молекулярные орбитали аналогичны орби-талям tzg и eg в модели кристаллического поля, и поэтому здесь возможна альтернативная интерпретация расположения уровней энергии. [44]
На рис. 15 - 7 показаны две шкалы энергии. Слева находится шкала, на которой энергия для уровня п 1 равна нулю. На этой шкале уровни энергии соответствуют нашему коромыслу весов с засечками. Шкала, расположенная справа, смещена вверх, и уровень п 1 соответствует отрицательной энергии, равной - 313 6 ккал. Очевидно, расположение уровней энергии не зависит от такого произвольного выбора нуля энергии, поэтому можно пользоваться любой шкалой. По причинам, которые будут изложены ниже в этой главе, правая шкала более удобна и применяется гораздо чаще. [45]
Страницы: 1 2 3 4