Расположение - электрон
Cтраница 1
 |
Сопоставление электронных конфигураций двухвалентного никеля в тетраэдрических и плоских квадратных комплексах. [1] |
Расположение электронов в обоих случаях изображено на рис. 12.3. Это существенное различие в магнитных свойствах применялось для доказательства того, что расположение лигандов вокруг атома никеля в Ni ( NH3) 4SO4, Ni ( N21 4) 280) 4 и б с-ацетилацетонате никеля отличается, например, от плоской конфигурации, наблюдаемой в K2Ni ( CN) 4, глиоксимате никеля, фтало-цианине никеля и во многих других соединениях. [2]
Расположение электронов внутри этой кристаллической решетки как раз и определяет направления и интенсивности пучков рассеянных ими рентгеновских лучей. Естественно, электронная плотность определяется структурой молекулярных единиц и порядком их упаковки в кристалле. Упаковка молекул в кристалле характеризует симметрию распределения электронной плотности и размер наименьшего повторяющегося в одном направлении трехмерного фрагмента кристалла, называемого элементарной ячейкой. Используя простую фотографическую технику, часто можно определить размер и симметрию элементарной ячейки, а зная число молекул в ячейке, часто можно получить информацию об элементах симметрии интересующей нас молекулярной частицы. Этой информации может быть вполне достаточно для удовлетворительного определения молекулярной структуры, хотя для получения и интерпретации фотографических данных требуется только несколько часов работы в вечернее время. Разделы 17.2 - 17.5 посвящены соотношениям симметрия - интенсивность, которые необходимо понять для проведения исследований подобного типа. Ниже мы рассмотрим различные аспекты симметрии элементарной ячейки. [3]
Расположение электронов по энергетическим уровням и орбиталям называется электронной конфигурацией. Конфигурация может быть изображена в виде так называемых электронных формул, в которых цифрой впереди указан номер энергетического уровня, затем буквой обозначен подуровень, а вверху справа от буквы - число электронов на данном подуровне. Сумма последних чисел соответствует величине положительного заряда ядра атома. [4]
Расположение электронов в атомах представляют в виде электронных формул, в которых соответствующая цифра перед буквенным выражением подуровня указывает номер энергетического уровня, а цифры справа вверху обозначают число электронов, находящихся в данном состоянии. [5]
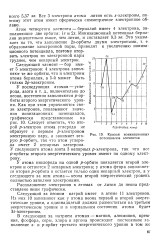 |
Кривая ионизационных потенциалов элементов. [6] |
Расположение электронов в атомах от лития до неона представлено ниже графически. [7]
 |
Схема возбуждения валентного состояния атома углерода. [8] |
Расположение электронов на различных орбиталях уменьшает их взаимное отталкивание, что энергетически выгодно. [9]
Расположение электронов внутри атома в его различных слоях или оболочках определяется энергией притяжения электрона к ядру и энергией его отталкивания от всех остальных электронов. В соответствии с этим положение каждого электрона в атоме и его энергия характеризуются четырьмя так называемыми квантовыми числами. Первые три из них являются целочисленными. [10]
Расположение электронов внутри атома определяется для каждого из них набором четырех квантовых чисел, характеризующих его энергию. Именно вследствие этого запрета числа электронов в отдельных слоях ( оболочках) внутри атома не могут быть больше определенной величины. [11]
Расположение электронов вокруг ядра и их поведение определяются законами квантовой или волновой механики. Электроны, вращающиеся вокруг ядра атома, могут находиться от него на разных расстояниях, то есть находиться на разных энергетических уровнях. [12]
Расположение электронов по уровням в атомах этих элементов можно представить так: 2, 8, 1 и 2, 8, 8, 1, откуда видно, что у атома калия внешний электрон находится дальше от ядра, чем у натрия, и, следовательно, легче отрывается. Поскольку металлически свойства обусловливаются способностью отдавать электроны, они будут сильнее выражены у калия. [13]
Расположение электронов показывает, что гадолиний занимает как бы центральное положение внутри всей группы лантанидов; по обе стороны от него расположено по 6 элементов, не имеющих 5d электронов, причем оба эти ряда элементов замыкаются полными, аналогами гадолиния - лантаном и лютецием. [14]
Расположение электронов, при котором потенциально под-движные электроны ( как правило, неподеленные пары и электроны л-связей) разделены простой связью. В системе при подходящей геометрии возможна делокализация. [15]
Страницы: 1 2 3 4 5