Расположение - электрон
Cтраница 3
Однако порядок расположения электронов по уровням может быть найден и теоретически. Мы уже видели, что соответствующие приближенные методы квантовой механики ( § 42 - 45) позволяют с достаточно хорошей точностью вычислить энергии стационарных состояний атомов. Тем самым может быть теоретически решен вопрос: на каком из возможных с точки зрения принципа Паули уровней будет нормально находиться электрон. [31]
При таком расположении электронов в возбужденном атоме кислорода нельзя утверждать о нарушении правила Гунда ( см. раздел 3.6), так как последнее относится к атому, находящемуся в основном состоянии. Можно предположить, что подобная рекомбинация электронов в атоме кислорода снимает вырождение с трех р - АО и одна из них, уже вакантная, приобретает другое значение энергии, становится активной для участия в образовании химической связи. [32]
Вопрос о расположении электронов вокруг атомного ядра в количественной, точной форме был впервые поставлен теорией Бора. [33]
Предметом обсуждения являются расположение электронов в ковалентлых мостиках между остовами атомов, занимающих узлы кристаллической решетки, и эффективные заояды атомов. [34]
Предметом обсуждения являются расположение электронов в ковалентных мостиках между остовами атомов, занимающих узлы кристаллической решетки, и эффективные заряды атомов. [35]
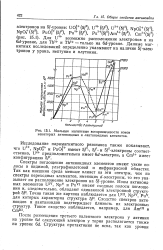 |
Мольные магнитные восприимчивости ионов некоторых актиноидных и лантаноидных элементов. [36] |
Для U4 возможно расположение электронов и на 6 -уровне, для Th3 и Th2 - только на Gd-уровне. Данные магнитных исследований определенно указывают на наличие 5 / - элек-тронов у урана, нептуния и плутония. [37]
Наиболее вероятное и наиболее стабильное расположение электронов называется электронной конфигурацией атома. [38]
В настоящее время расположением электронов в атомах объясняются многие свойства химических элементов. [39]
Подобное представление о расположении электронов вокруг ядра атома было принято при уточнении вышеописанной планетарной схемы строения атомов. [40]
Это дает основание представлять расположение электронов в атоме слоями ( см. рис. 1.1), каждый из которых может иметь определенное число электронов. [41]
Менделеева, составьте схемы расположения электронов по ор-биталям и энергетическим уровням в атомах элементов ванадия V, никеля Ni и мышьяка As. Какие из них относятся к р-элементам и какие - к d - элементам и почему. [42]
Сверхтонкие поля в месте расположения электрона могут достигать нескольких десятков гаусс. [43]
В зависимости от природы лигандов расположение электронов на орбиталях может изменяться. В случае слабого поля лиганда электроны заполняют как верхний rfv, так и нижний de уровень, на указанных уровнях находятся при этом непарные электроны. Такие комплексы относятся к высокоспиновым. В сильном поле лиганда электроны заполняют попарно более низкие орбитали и только затем начинается заполнение dv - уровней. В таких комплексах бывает не более одного непарного электрона, и их называют низкоспиновыми. В качестве примера на рис. 1.7 - 76 приведено распределение электронов для двух комплексов двухзарядного иона железа. Характер распределения энергии оказывает влияние на свойства комплекса. По значениям А все лиганды могут быть расположены в ряды: спектрохимический, гипсо-хромный и нефелоксетический. В том же ряду приведены средние значения lg i для комплексов этих лигандов с ионами некоторых металлов. [44]
На рис. 1.15 схематически показано расположение электронов и ядер молекулы водорода, состоящей из двух атомов. [45]
Страницы: 1 2 3 4 5