Пространственное расположение - заместитель
Cтраница 2
А), а следовательно, пространственное расположение заместителей еще более тесное. [16]
Существенное влияние на скорость этерификации оказывает пространственное расположение заместителей около реакционных центров. Так, о о-дизамещен-ные бензойные кислоты этерифицируются с трудом, тогда как этерификация о о-дизамещенных фенилуксусных кислот идет легко. [17]
Стереоизомерия органических молекул может быть вызвана пространственным расположением заместителей вокруг азота, фосфора и других многовалентных атомов, входящих в их состав. Наиболее подробно изучена стереоизомерия органических соединений азота. Для этих соединений известны различные типы сте-реоизомерии: оптическая активность, вызываемая асимметрическим атомом азота; асимметрия за счет спиранового азота; атропо-изомерия, а также геометрическая изомерия, соответствующая цис-транс-изомерии этиленовых соединений. [18]
На основании этого можно утверждать, что пространственное расположение заместителей вокруг асимметрических атомов ( -) - треозы такое же, как и ( -) винной кислоты, конфигурация которой надежно установлена рентгенографическим методом. [19]
На основании этого можно утверждать, что пространственное расположение заместителей вокруг асимметрических атомов ( - ) - треозы такое же, как и для ( - ) - винной кислоты, конфигурация которой надежно установлена рентгенографическим методом. [20]
Очевидное следствие из сказанного: чтобы выразить пространственное расположение заместителей вокруг асимметрического атома, лучше основываться непосредственно на пространственной модели; это сразу снимает все трудности, связанные с выбором стандартной формы изображения модели плоской формулой. [21]
Характерная особенность синдиотактического полимера - правильное чередование пространственного расположения заместителей Н и СН3: каждая из групп оказывается по одну сторону плоскости чертежа в каждом втором звене. [22]
Характерная особенность синдиотактического полимера - правильное чередование пространственного расположения заместителей Н и СНз: каждая из групп оказывается по одну сторону плоскости чертежа в каждом втором звене. [23]
Возможность и степень поворота определяются размерами и пространственным расположением заместителей в цикле. Например, у p - D-глюкозы гидроксильная группа у С2 изменяет положение из экваториального на аксиальное, а у [ i - D-маннозы происходит обратное явление. Поэтому ман-ноза при гидролизе отщепляется быстрее, чем глюкоза. [24]
Возможность и степень поворота определяются размерами и пространственным расположением заместителей в цикле. Например, у p - D-глюкозы гидроксильная группа у С2 изменяет положение из экваториального на аксиальное, а у p - D-маннозы происходит обратное явление. Поэтому ман-ноза при гидролизе отщепляется быстрее, чем глюкоза. [25]
Для каких С-атомов наблюдает ся различие в пространственном расположении заместителей в молекулах галактозы и глюкозы. [26]
Превращение переходного состояния в конечный продукт сопровождается изменением пространственного расположения заместителей, связанных с асимметрическим атомом углерода; происходит перестройка асимметрического центра, приводящая к обращению конфигурации молекулы и в данном случае к перемене знака ее оптической активности. [27]
Превращение переходного состояния в конечный продукт сопровождается изменением пространственного расположения заместителей, связанных с асимметрическим атомом углерода. Происходит перестройка асимметрического центра, приводящая к обращению конфигурации молекулы и в данном случае к перемене знака ее оптической активности. [28]
Другим важным структурным фактором при гидрировании непредельных соединений является пространственное расположение заместителей у двойной связи. Транс-изомеры гидрируются обычно труднее, чем соответствующие г ыс-изомеры. Количество и порядок расположения двойных связей в молекуле также оказывают влияние на скорость и легкость гидрирования. Ароматическое кольцо гидрируется обычно труднее, чем изолированная двойная связь. [29]
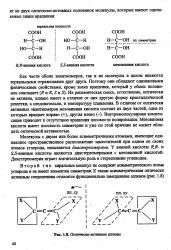 |
Оптически активные аллены. [30] |
Страницы: 1 2 3 4