Относительное расположение - кривая
Cтраница 3
Движение от кулачковых барабанов подающим салазкам и муфте передается рычагами. Относительное расположение кривых на барабанах таково, что первыми вступают в работу салазки подачи материала, отходящие влево на величину настроенной подачи. [31]
Уменьшение суммарного времени обработки эмульсии по сравнению с первым на 35 % эквивалентно такому же увеличению производительности отстойной аппаратуры. Характер относительного расположения кривых для различного времени турбулизации эмульсии позволяет предполагать, что возрастание скорости отстоя при увеличении времени турбулизации эмульсии связано с улучшением массообмена и более глубоким разрушением бронирующих оболочек. Однако графики, представленные на рис. 1.43 а, исключают возможность такого объяснения. В данном случае кривые 1, 2, 3, 4 характеризуют темп отделения воды от нефти при отстое эмульсии, сформированной смешением нефти с водой, в которую предварительно был введен деэмульгатор, и, следовательно, необходимость в осуществлении и завершении массообменных процессов и доведении реагента до каждой глобулы пластовой воды не возникала. [32]
Рассматривая горизонталь монотектического трехфазного равновесия по аналогии с описанным выше эвтектическим равновесием как сочетание трех коннод, будем иметь картину относительного расположения кривых концентрационной зависимости изобарно-изотермического потенциала трех равновесных фаз, геометрически полностью аналогичную показанной на рис. 52 а. Соответствующие картины, иллюстрирующие изменения относительного расположения кривых концентрационной зависимости изобарно-изотермического потенциала трех рассматриваемых фаз, будут в принципе аналогичны показанным на рис. 53 в для системы эвтектического типа. При этом относительное перемещение соответствующих участков указанной кривой и кривой G ( a) / - f ( xB) при изменении температуры полностью аналогичны наблюдаемым в эвтектической системе. [33]
Таким образом, рассмотренное правило об относительном расположении кривых фазового равновесия имеет ограничения. Поэтому в каждом отдельном случае следует анализировать термодинамическую возможность имеющегося относительного расположения кривых фазового равновесия, используя объективный и наглядный метод геометрической термодинамики и избегая бессознательного применения правила о невозможности продолжения кривых равновесия в однофазных областях диаграмм состояния. [34]
Если в Гх-диаграмме две логарифмические кривые изображают в одних и тех же пределах температур процессы: одна - изохорный, а другая - изобарный, то в случае процесса нагревания линия uconst пойдет выше, а линия pconst - ниже ( р ис. Si) p ( s2 - Si) v, что определяет указанное относительное расположение кривых. [35]
Геометрическое место ( bt) центров b ( i) плоскости В Зейлигер назвал неподвижной централей положения At. Кривые ( at) и ( bt) совпадают лишь в положении At, так как кривая ( aj, согласно ее определению, движется - вместе с фигурой А. Относительное расположение кривых ( аг) и ( br) в момент t определяется следующей теоремой. [36]
Относительное расположение кривых, а также концентрация ССЦ, при которой наблюдается изменение характера кривой, зависят от типа экстрагента и относительного количества воды в системе. С усилением основных свойств фосфорорганиче-ской молекулы кривые аналогично тому, как это отмечено на рис. 1, смещаются в область слабых полей. Сравнение кривых 2 и 5 и их совпадение при Ccci4 80 об. % показывает, что увеличение содержания воды смещает зависимость бн ( Сса. CCU протонный химический сдвиг, соответствующий воде, по-видимому меняется независимо от ее количества в системе. [37]
Фрейндлих, весьма резко понижается в присутствии посторонних примесей особенно примесей поверх-ностноактивныхвеществ, адсорбирующихся на гранях с п Нижением их поверхностного натяжения ( см. Пассивирование адсорбционное, Капиллярные явления, Жидкости, Адсорбция) и тем препятствующих их росту. Тамман показал, что зависимость N от i ( от переохлаждения AT) определяется кривой, изображенной на фиг. Относительное расположение кривых v и N определяет все условия К. [38]
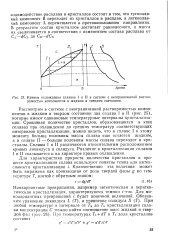 |
Кривые охлаждения сплавов I и II в системе с неограниченной растворимостью компонентов в жидком и твердом состоянии. [39] |
Рассмотрим в системе с неограниченной растворимостью компонентов в жидком и твердом состоянии два сплава I и II ( рис. 25), которые имеют одинаковые температурные интервалы кристаллизации. Сравнивая количество кристаллов, образовавшихся в этих сплавах при охлаждении до средних температур соответствующих интервалов кристаллизации, можно видеть, что в сплаве I к этому моменту больше половины массы сплава еще остается жидким, а в сплаве II - больше половины массы сплава переходит в кристаллы. Сплавы I и II различаются относительным расположением кривых ликвидуса и солидуса. Различие в кристаллизации сплавов I и II сказывается и на характере кривых охлаждения. [40]
Электрокинетический потенциал вода - кварц, измеренный в опытах, был равен - 46 мв. Такая величина его обусловливала достаточно большую составляющую общего движения, направленную к отрицательному полюсу внешней цепи. Различие в направлениях обеих составляющих и приводило, очевидно, к наблюдаемому относительному расположению кривых Qeo f ( t) и Q f ( t) для керосина и декалина. Принимая во внимание общее направление движения жидкостей в опытах, большее значение имела составляющая, связанная с действием двойного слоя на границе с твердым телом. [41]
 |
Схема энтальпии образования газообразных комплексов ртути с галогенами на различных ступенях координации. [42] |
Если, наконец, учесть изменение энтальпии при гидратации самих комплексов, то в среднем кривые могут несколько сблизиться. Наклон их должен уменьшиться, так как разность между изменениями энтальпии при гидратации последующего комплекса и предыдущего с повышением ступени координации в среднем растет. Принципиально возможно даже изменение знака наклона. Но относительное расположение кривых между собой едва ли сильно изменится, так как энергии гидратации столь крупных и сходных по природе ионов, как комплексные галоге-ниды ртути одинаковых ступеней координации, по-видимому, должны мало различаться. [43]
 |
Зависимость Д / / к галогенидных комплексов ртути от ступени координации. [44] |
На рис. 4 а, б представлены экспериментальные кривые изменения энтальпии при ступенчатом комллексообразовании отдельно для четных и нечетных ступеней. Совпадение экспериментальных данных со схемой рис. 3 6 для ступеней одинаковой четности очевидно. Согласование в относительном расположении кривых имеется и при объединении всех ступеней координации одной кривой ( рис. 1), однако в этом случае картина усложняется изломами кривых, не предусмотренными в схеме. [45]
Страницы: 1 2 3 4