Тетраэдрическое расположение - связь
Cтраница 3
Как уже указывалось, четыре валентности атома углерода имеют тетраэдрическое расположение. Однако не всегда координационному числу 4 отвечает тетраэдрическое расположение связей. Например, ион [ PdCU ] 2 имеет плоскую квадратную конфигурацию. [31]
Как уже указывалось, четыре валентности атома углерода имеют тетраэдрическое расположение. Однако не всегда координационному числу 4 отвечает тетраэдрическое расположение связей. Например, ион IPdCUl имеет плоскую квадратную конфигурацию. [32]
Кристаллическая структура алмаза представляет собой первый пример правильного тетраэдрического расположения связей углерода. В этом кристалле каждый атом углерода соединен с четырьмя равноудаленными соседями, и соответственно способ образования связей, показанный на рис. 21.1, сохраняется во всем кристалле. [33]
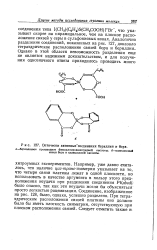 |
Оптически активные соединения бериллия и бора. [34] |
ВГ, что указывает скорее на пирамидальное, чем на плоское расположение связей у серы в сульфониевых ионах. Аналогично разделение соединений, показанных на рис. 127, доказало тетраэдрическое расположение связей бора и бериллия. [35]
Как уже указывалось, четыре валентности атома углерода имеют тетраэдрическое расположение. SOl, POl и др.) - Однако не всегда координационному числу 4 отвечает тетраэдрическое расположение связей. Например, ион [ PdCl4 ] 2 - имеет плоскую квадратную конфигурацию. Возможны также различные значения валентных углов при окружении центрального атома 3, 5, 6 и большим числом соседей. Валентные углы несут важную информацию о природе химической связи, некоторые закономерности в их изменении будут рассмотрены в дальнейшем. [36]
В квантовой химии Полинг и Слейтер - представители метода валентных связей, или, что то же, метода локализованных пар, Хунд и Малликен - представители метода молекулярных орбит. Как показал вскоре Ван Флек [2], в рамках последнего метода нет необходимости для объяснения тетраэдрического расположения связей С - Н в метане прибегать обязательно к представлению о гибридизации s - и р-орбит. Тем не менее трактовка углеродного тетраэдра в современной литературе сводится, как правило, к представлению о тетраэдрической 5р3 - гибридизации атомных орбит углерода ( см., например, [ 8, стр. Учение о гибридизации прочно укоренилось в теоретической химии, возможно, потому, что оно оказалось способным к дальнейшему развитию и стало широко привлекаться для истолкования не только отклонений от тетраэдричности валентных углов насыщенного атома углерода, но также и данных по межатомным расстояниям, о чем речь будет идти далее. [37]
 |
Структура молекулы As484. [38] |
Известно большое число соединений типа РХ, ОРХ3 или S РХ3, которые, как и предполагалось, имеют тетраэдрическое строение. Когда лиганды идентичны, например в PHI, PClt, As ( C6H5) t и PCY 3, осуществляется конфигурация правильного тетраэдра. Тетраэдрическое расположение связей вокруг атома фосфора обнаружено в ди - и трифосфатах и других родственных сложных анионах. [39]
Они получены путем так называемого неэмпирического квантовохимического расчета. Нижняя, самая связывающая орбиталь yi охватывает все пять атомов. Хотя на рис. 1.14 показано тетраэдрическое расположение связей, форма орбитали ц вовсе не говорит об этом. Ясно лишь то, что все пять ядер расположены внутри u / i, но вопрос о том, как они расположены, даже не ставится. Выше орбитали xyi располагаются три вырожденные заполненные орбитали ц2, Цз, Ц4 - Каждая из этих орбиталей имеет по одной узловой плоскости, проходящей через атом углерода. [41]
 |
Тетраэдрическое расположение связей.| Расщепление rf - орбиталей в тетраэдрическом ( а и в плоском квадратном полях лигандов ( масштаб не соблюден. [42] |
Тетраздрическое расположение свялей обнаружено в комплексах двухвалентных бериллия, цинка, кадмия и ртути, а также трехвалентных бора, алюминия и галлия. Эти элементы не имеют rf - орбиталей, сравнимых по энергии с s - и р-орбиталями валентной оболочки. Поэтому при координационном числе четыре следует ожидать тетраэдрическое расположение связей. [43]
Большой интерес представляет строение простых диоксодифторидов молибдена и вольфрама. Нельзя, конечно, считать полностью исключенным и тетраэдрическое расположение связей в комплексе Mo02F2 без участия молекул воды. [44]
Еще в 1933 г. Ван Флек [12] высказал предположение, что радикал СН3 - плоский. Ход рассуждения был при этом таков: из энергий связей следует, что реакция СН4 - СН3 Н должна идти с поглощением 121 ккал / моль, а в действительности она требует на 15 - 20 ккал / моль меньше. Можно предположить, что происходит выигрыш энергии за счет перехода из тетраэдрического расположения связей в плоское - по-видимому, более стабильное. [45]
Страницы: 1 2 3 4
