Тетраэдрическое расположение - связь
Cтраница 4
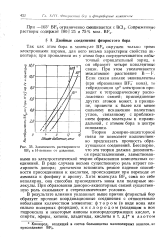 |
Зависимость растворимости BF3 в Н - пентане от давления. [46] |
Так как атом бора в молекуле BF3 окружен только тремя электронными парами, для него весьма характерны свойства акцептора; при проявлении их у атома бора сосредоточивается избыточный отрицательный заряд, и он образует четыре ковалентные связи. При этом увеличивается межатомное расстояние В - F. Если связи вполне эквивалентны ( при образовании ВРГ иона), то гибридизация sp3 электронов приводит к тетраэдрическому расположению связей; присоединение других атомов может, в принципе, привести к более или менее сильному искажению валентных углов, связанному с приближением формы молекулы к пирамидальной, с атомом бора в центре основания. [47]
 |
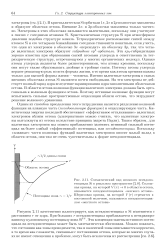
Структура кристаллов полиэтилена. [48] |
Поперечные размеры ячейки почти совпадают с размерами для углеводородов с более короткими цепями. В действительности положения атомов водорода в такой структуре не были определены из рентгенографических данных, поскольку рентгенограмма полимера не дает возможности сделать это достаточно точно; эти положения были найдены при допущении о тетраэдрическом расположении связей и длине связи С - Н, равной 1 08 А. Исследование относительной интенсивности рефлексов также показало, что отклонение атомов от их средних положений за счет тепловых колебаний и дефектности кристаллов ( как и следовало ожидать) значительно больше в поперечном направлении цепи, чем в продольном. [49]
 |
Схематический вид атомного псевдопотенциала SI в реальном пространстве. Сплошная кривая, на которой V ( г - 0 в области остова, называется псевдопотенциалом мягкого остова. [50] |
В кристаллическом Si орбитали Is, 2s и 2р полностью заполнены и образуют оболочки остова. Внешние 3s - и Зр-оболочки заполнены только частично. Электроны в этих оболочках называются валентными, поскольку они участвуют в связях с соседними атомами Si. Кристаллическая структура Si при атмосферном давлении подобна структуре алмаза. Тетраэдрическое расположение связей между атомом Si и его четырьмя ближайшими соседями становится понятным, если учесть, что один из электронов в оболочке 3s переходит на оболочку Зр, так что четыре валентных электрона образуют гибридные sp3 - орбитали. Эта 5рз бридизация хорошо известна при образовании связей атомами углерода и ответственна за тет-раэдрическую структуру, встречающуюся у многих органических молекул. Однако атомы углерода являются более разносторонними, чем атомы кремния, поскольку они могут также образовывать двойные и тройные связи. Поэтому атомы углерода играют решающую роль во всех формах жизни, в то время как атомы кремния важны только для высшей формы жизни - человека. Именно валентные электроны в самых внешних оболочках атома Si являются почти свободными. На эти электроны не действует полный заряд ядра вследствие экранирования ядра заполненными оболочками остова. В области остова волновая функция валентного электрона должна быть ортогональна к волновым функциям остова. Поэтому истинные волновые функции могут испытывать сильные пространственные осцилляции вблизи остова, что затрудняет решение волнового уравнения. [51]
Это означает уменьшение доли участия s - облаков в образовании гибридных связей в случае фосфина. Кроме того, связи фосфора с водородом менее прочны, чем связи последнего с азотом, а электрический момент диполя аммиака почти втрое превосходит момент диполя фосфина. Донорные свойства у РН3 выражены несравненно слабее, чем у аммиака. Последний является аналогом аммоний-иона и характеризуется тетраэдрическим расположением связей. [52]
Эти выводы являются важнейшими для стереохимии результатами работы Крэйга и его соавторов. Заключение относительно использования d - орбит при образовании и-связи позволяет дать общее объяснение ряду экспериментальных фактов. Это может приводить к перекрыванию ковалентной связи ближе к лиганду, чем при использовании низших ( 3d) орбит. Указанное обстоятельство важно в случае образования комплексов с более электроотрицательными атомами или группами. Применимость этого положения, к другим молекулам обсуждается в работе Коулсона ( Coulson, 1952в), который подчеркивает, что в последнее время концепция ионно-ковалент-ного резонанса становится все менее значимой. Так, известно, что в первом переходном ряду ( Ti - Cu) некоторые элементы ( например Ni11 и Со11) дают четырехковалентные комплексы, у которых наблюдается как квадратное, так и тетраэдрическое расположение связей. В случае никеля один из типов комплексов характеризуется обычно синей или зеленой окраской и магнитным моментом, равным примерно 3 2 - 3 4 и указывающим на наличие двух неспаренных электронов. [53]
В циклогексане наблюдаются три полосы в этой области. Наилучшее разрешение достигается в к-гептане, где полосы наименее уширены и где отчетливо наблюдаются шесть полос валентных колебаний СО. Однако, к сожалению, большинство исследованных соединений очень плохо растворимо в н-гептане. Соотношение интенсивностей двух высокочастотных полос различно для разных веществ, хотя одинаково для соответствующих производных молибдена и вольфрама. Для ХС6НБ, SCN, N02 наблюдается обратное соотношение интенсивностей. Для производных типа [ C5H5 ( CO) 2Fe ] 2SnX2 было показано [10], что к такому изменению соотношения интенсивностей может привести существование геометрических изомеров за счет вращения вокруг связи металл - олово. Возможно, что в ряду производных молибдена и вольфрама также имеет место подобное явление. Рассматривая изменения дипольного момента молекулы в обсуждаемых колебаниях как сумму изменений моментов отдельных связей СО и предположив тетраэдрическое расположение связей вокруг атома олова, мы пришли к заключению, что высокочастотная полоса должна быть более интенсивна, чем соседняя при ориентации связей металл - циклопента-диенильное кольцо в одну сторону и менее интенсивна при противоположной ориентации. При промежуточных ориентациях соотношение интенсивностей также должно быть промежуточным. [54]
Страницы: 1 2 3 4