Распределение - отрицательный заряд
Cтраница 1
Распределение отрицательного заряда между тремя центрами увеличивает электронную плотность в этих положениях и приводит к орто - и пара-замещению. [1]
Распределение отрицательного заряда между тремя центрами увеличивает электронную плотность в этих положениях и приводит к ор-то - и пара-замещению. [2]
Ясно, что распределение отрицательного заряда в таких асимметричных ионах, как ( N02) CeH40 - неоднородно. Кирквуд [ 761 получил выражение для химического потенциала иона сферической формы с суммарным зарядом ze, образованным произвольным числом произвольно распределенных в нем элементарных зарядов. [3]
Ясно, что распределение отрицательного заряда в таких асимметричных ионах, как ( N02) CeH40 - неоднородно. [4]
В молекулярных системах распределение отрицательных зарядов является функцией плотности вероятности распределения электронов j) 2, где ф-волновая функция молекулы. [5]
Это связано с распределением отрицательного заряда между фенольным кислородом и нитрогруппами ( что часто представляют резонансными структурами) и проявляется в интенсивном поглощении в видимой или ближней ультрафиолетовой части спектра. Таким образом, при переходе от воды к растворителю, в котором непосредственное окружение иона содержит поляризуемые молекулы, должна происходить дополнительная стабилизация относительно недиссоциированной кислоты за счет дисперсионного взаимодействия. Следствием этого является аномально высокая степень диссоциации пикриновой кислоты. Маловероятно, однако, чтобы он имел широкое распространение. [6]
Изучено несколько систем с распределением отрицательного заряда между атомами углерода. Наиболее замечательный случай мезомерии такого типа был открыт Рамирезом и Леви [130] в 1956 г. Они нашли, что циклопентадиенилидентрифенилфосфо-ран LXVII на редкость стабильный илид. Он высокоплавок и не изменяется после кипячения со спиртовым раствором едкого кали; после такой операции большинство илидов превращается в окись трифенилфосфина и углеводород. Кроме того, этот илид не вступает в реакцию Виттига с карбонильными соединениями. Его илидный характер был подтвержден тем, что он растворяется в разбавленной соляной кислоте. [7]
Где должен быть расположен настоящий центр тяжести распределения отрицательного заряда в реальной молекуле. [8]
Снова на атоме углерода сосредоточен небольшой положительный заряд, однако распределение отрицательного заряда между атомами серы и азота существенно иное. [9]
Формула ( 77) будет для нас нужна прежде всего для определения распределения полного отрицательного заряда системы и распределения в пространстве полной энергии электронов в поле ядер. [10]
Кирквуд и Райземан в 1948 г. предложили полиэлектролитическую модель, согласно которой молекулы АТФ вызывают такое распределение отрицательных зарядов в белковых молекулах, при котором они растягиваются под действием электростатических взаимодействий. При расщеплении молекул АТФ эти заряды утрачиваются и нити сокращаются. [11]
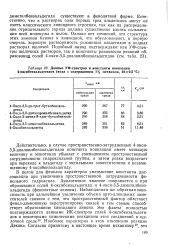 |
Данные УФ-спектров и константы ионизации 4-оксибензальдегидов ( вода с содержанием 1 % метанола, 22 0 5 С. [12] |
Естественно, что в растворах соли первых трех альдегидов могут не иметь классического хиноидного строения, так как на распределение отрицательного заряда должна существенно влиять сольватация всей молекулы в целом. Однако нет сомнений, что структура этих анионов близка к хиноидной, что обусловливает, в первую очередь, хорошую растворимость указанных альдегидов в водных растворах щелочей. [13]
В квантовой теории атома получается автоматически, что стационарному состоянию атома соответствуют некоторое статическое ( не зависящее от времени) распределение отрицательного заряда электронной оболочки и некоторый стационарный замкнутый ток. [14]
Электроны удерживаются в металле электростатическими силами Существенно, что эти силы создаются не только остаточными положительными зарядами, но также и распределением отрицательных зарядов. [15]
Страницы: 1 2 3