Равновесное распределение - энергия
Cтраница 1
Равновесное распределение энергии между системами ( XIi) и ( Ху отличается от всех возможных распределений тем, что ему соответствует наибольшая энтропия. [1]
Нарушения равновесного распределения энергии в результате химической реакции могут быть обусловлены двумя причинами. Первая из них заключается в уменьшении концентрации наиболее богатых энергией молекул, потребляемых реакцией. Это наиболее ярко проявляется в эндотермических процессах, в частности, в процессах диссоциации, приводящих к уменьшению концентрации молекул на высоких колебательных уровнях. [2]
Установление равновесного распределения энергии по колебательным степеням свободы молекул в газах имеет две особенности. Энергетическая емкость колебательных степеней свободы значительно выше, чем поступательных и вращательных. [3]
Это подтверждает, что равновесное распределение энергии между молекулами и поверхностью ионной камеры устанавливается раньше, чем наступает ионизация. Несколько упрощенное сопоставление относительных объемов ионной камеры и электронного пучка показывает, что при низком давлении, когда свободный пробег достаточно велик, молекула успевает много раз столкнуться со стенками, прежде чем пересечет электронный пучок. [4]
В реагирующих газах не может происходить равновесное распределение энергии, даже если рассматривать возможность образования новых типов молекул в результате химической реакции. Если молекула вследствие химической реакции перешла в возбужденное состояние, то весьма существенное значение имеют ее последующие превращения. Среднее время, необходимое молекуле для излучения света и перехода в основное состояние ( время жизни), для разрешенных электронных переходов составляет Ю-6... В газах обычных пламен, горящих при атмосферном давлении, молекулы испытывают около 109 соударений за 1 с, если предполагать, что их поперечные сечения имеют нормальную величину. Но молекулы, находящиеся в возбужденном состоянии, должны иметь большие поперечные сечения. Таким образом, можно принять, что возбужденная молекула в газе под атмосферным давлением испытывает от 10 до 1000 столкновений, что явно недостаточно для достижения равномерного распределения энергии по степеням свободы. Поскольку в ряде случаев давление составляет 0 1 или даже 0 01 атмосферного, невозможность выравнивания распределения энергии в течение времени жизни возбужденной молекулы в этих условиях становится еще более очевидной. Восстановлению равновесного распределения энергии препятствуют также огромные градиенты температур в пламенах, достигающие сотен тысяч Кельвинов на миллиметр. [5]
Второй причиной, приводящей к нарушению равновесного распределения энергии в ходе химической реакции, является выделение энергии, распределяющейся между молекулами продуктов реакции. Эта причина наиболее существенное значение имеет в случае экзотермических процессов. Суммарное количество выделяющейся энергии равно энергии активации данного элементарного ( экзотермического) процесса Е0 плюс теплота реакции Q, Еп Q. Выделяющаяся энергия превращается в энергию поступательного движения ЕПОСТ и внутреннюю энергию Л Ш1 продуктов реакции. Впервые явное указание на существование значительных неравновесных аффектов было получено при исследовании мономолокулярных реакций в области низких давлений, где переход от реакции первого порядка ко второму является следствием нарушения равновесного распределения реагирующих молекул по состояниям в области энергий, близких к энергии активации. [6]
Второй причиной, приводящей к нарушению равновесного распределения энергии в ходе химической реакции, является выделение энергии, распределяющейся между молекулами продуктов реакции. Эта причина наиболее существенное значение имеет в случае экзотермических процессов. [7]
С повышением температуры, все более нарушается равновесное распределение энергии по внутренним степеням свободы частиц в процессе их диссоциации. Скорость химической реакции в неравновесных условиях, вообще говоря, зависит от эффективных сечений многих элементарных процессов. Имеются, однако, случаи, когда даже при сильном нарушении равновесия возможно описание кинетики реакции на основе представлений о равновесной константе скорости. Это удается сделать, если в системе есть быстрые процессы, которые, хотя и не ведут к установлениях полного равновесия, но обеспечивают равновесие внутри подсистемы. Тогда неравновесность выражается лишь в том, что система характеризуется не одной, а двумя или несколькими температурами. [8]
Теоретические расчеты проводились только в предположении наличия равновесного распределения энергии по поступательным степеням свободы, что позволяет определить лишь нижнюю границу времени вращательной релаксации. Имеются расчеты как в рамках классических представлений, так и квантовомеханическими методами. [9]
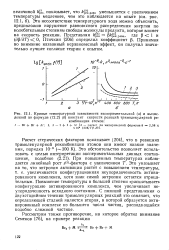 |
Кривые температурной зависимости экспериментальной ( а и вычисленной по формуле ( б констант скорости реакций тримолекулярной рекомбинации атомов. [10] |
Это несоответствие температурного хода можно объяснить, предположив нарушение равновесного распределения энергии по колебательным степеням свободы молекулы продукта, которое влияет на скорость реакции. [11]
Охлаждение пламени вследствие естественной и вынужденной конвекции и неполнота сгорания вследствие охлаждения могут не препятствовать установлению равновесного распределения энергии в газах, однако обусловливают более низкие значения температур по сравнению с адиабатическими. [12]
Конкуренция между этими двумя факторами приводит к тому, что, например, при высоких температурах, когда вследствие большой скорости реакции нарушения равновесного распределения энергии могут быть особенно велики, приходится решать систему уравнений химической кинетики и тепловой ( колебательной) релаксации. И если параметрами кинетических уравнений являются константы скорости реакций, которые должны быть известны, то решение релаксационных уравнений предполагает знание вероятностей или констант скорости процессов обмена энергии при столкновениях молекул. Поэтому процессы обмена энергии представляют огромный интерес с точки зрения неравновесной кинетики. [13]
Мы рассматривали такие процессы, когда реагирующая газовая смесь в каждый момент времени находится в состоянии полного термодинамического равновесия: в ней осуществляется как равновесное распределение энергии по степеням свободы частиц, так и химическое равновесие по составу смеси. [14]
Легко учесть вклад внутренних степеней свободы в теп лопередачу, если скорость перехода энергии от внутренних к поступательным степеням свободы молекул так велика, что устанавливаются равновесные распределения энергии по степеням свободы молекул, соответствующие локальной температуре. [15]
Страницы: 1 2 3 4