Зарядовое распределение
Cтраница 2
 |
Молекулярный граф системы связевых путей в B6Hg - ( каждый атом бора связан также с атомом водорода, который. [16] |
Этот молекулярный граф определяется свойствами зарядового распределения для данной молекулы. В центре поверхности каждого трехчленного цикла расположена критическая точка цикла. Величины р в критических точках связи и цикла различаются лишь на 0 007 а.е. - заряд делока-лизован по поверхности цикла. Напротив, в тетраэдране С4Н4 разность величин р в критических точках цикла и связи С-С равна 0 062 а.е. и заряд связей С-С клетки менее делокализован, чем заряд связей В-В. [17]
Образование комплекса всегда сопровождается изменением зарядового распределения компонентов. При диэлектрических измерениях это проявляется в том, что дипольный момент образованного соединения отличается от векторной суммы дипольных моментов исходных реагентов. Компоненты дипольного момента, обусловленные взаимодействием, естественно, тоже векторы, которые в Н - связанных ассоциатах направлены в сторону наиболее основного центрального атома. [18]
Метод Хартри - Фока хорошо описывает зарядовые распределения, потому что в конечных системах в нем учитывается в основном дальнодействующая часть кулоновских отталкиваний между электронами [9], а это приводит к простым выражениям для остающихся корреляционных эффектов и к удобной теории для них. Следовательно, метод Хартри - Фока является блестящей исходной точкой. [19]
Далее Инглэнд и Гордон [85] отделили атомное зарядовое распределение ц 1, где - атомная орбиталь, от двухатомной интерференции ( или перекрывания) jrv ( fi s A, v e В) согласно подходу, предложенному Рюденбергом [87] в известной статье о природе химической связи. [20]
Скорость изменения поляризации среды, подстраивающейся под зарядовое распределение субстрата, к-рое меняется в ходе р-ции, определяется диэлектрич. [21]
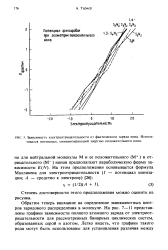 |
Зависимость электроотрицательности от фактического заряда иона. Использовался потенциал, минимизирующий энергию положительного иона. [22] |
Обратим теперь внимание на определение эквивалентных центров зарядового распределения в молекуле. На рис. 7 - 11 представлены графики зависимости полного атомного заряда от электроотрицательности для рассмотренных бинарных циклических систем, образованных серой и азотом. [23]
 |
Дигональные гибридные орбитали в ацетилене.| Декартовы координатные оси для этилена. [24] |
Хотя в многоэлектронных системах физический смысл имеет лишь общее зарядовое распределение, иногда полезно наглядное, хотя и приближенное, представление зарядового распределения, соответствующего компонентам одноэлектронной волновой функции. [25]
 |
Дигональные гибридные орбитали в ацетилене.| Связевые орбитали в ацетилене.| Декартовы координатные оси для этилена. [26] |
Хотя в многоэлектронных системах физический смысл имеет лишь общее зарядовое распределение, иногда полезно наглядное, хотя и. [27]
Полная теория основывается на единственном наиболее важном свойстве зарядового распределения - на том, что оно имеет локальные максимумы лишь в точках расположения ядер. [28]
 |
Квадрупольная диаграмма, показывающая все возможные резонансные спектры в случае дипольного перехода между состояниями со спинами 6 / 2 и 3 / г, если г 0. [29] |
Он электростатический по характеру и вызван кулоновским взаимодействием электронного зарядового распределения с зарядом ядра, распределенным по конечному объему. Для тяжелых элементов изомерный сдвиг может быть особенно большим. [30]
Страницы: 1 2 3 4 5