Раствор - железо
Cтраница 3
Последнее получают генерацией либо из растворов железа ( III) при соответствующем значении рН, либо же электрорастворением железного электрода на индифферентном фоне. [31]
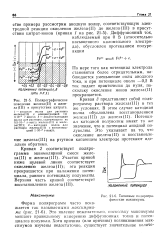 |
Полярографическое поведение железа ( II и железа ( III в присутствии цитрата. [32] |
Кривая 3 представляет собой поля-рограмму раствора железа ( III) в тех же условиях. Потенциал катодной полуволны имеет то же значение, что и потенциал анодной полуволны. Это указывает на то, что окисление железа ( II) и восстановление железа ( III) на ртутном капающем электроде протекают идеально обратимо. [33]
Убедившись в полном удалении из раствора железа, не прерывая тока, осторожно спускают ртуть в коническую колбу, а затем электролит в приготовленный стакан. Электролизер и прикрывавшие его половинки часового стекла ( предохранявшие раствор от разбрызгивания во время электролиза) обмывают водой из промывалки, собирая промывные воды в стакан с электролитом. [34]
Определение железа основано на колориметрировании раствора железа ( III) с насыщенным раствором салициловой кислоты при рН 2 - 3 с использованием желтого светофильтра. При этих условиях возникает прочный комплекс салицилата железа ( FeSal) с К. Салицилаты меди, алюминия и марганца в этих условиях неустойчивы. В щелочной среде наименее прочный комплекс с Кз - 2 Ю-6 [ Fe ( Sal) 3 ] 3 - окрашен в желтый цвет. [35]
Определение железа основано на колориметрировании раствора железа ( III) с насыщенным раствором салициловой кислоты при рН 2 - 3 с использованием желтого светофильтра. При этих условиях возникает прочный комплекс салицилата железа ( FeSal) с Ki 4 - 10 - 17, раствор которого окрашен в фиолетовый цвет. Салицилаты меди, алюминия и марганца в этих условиях неустойчивы. В щелочной среде наименее прочный комплекс с Кз - 2 Ю-6 [ Fe ( Sal) 3 ] 3 - окрашен в желтый цвет. [36]
Титр раствора комплексона устанавливают по раствору железа с известным содержанием и приблизительно такой же нормальности. [37]
К растворам добавляют 75 1 мл раствора железа п тщательно перемешивают 10 сек. Оставляют растворы на 5 мин. В это время наполняют две мерные колбы емкостью 50 мл до метки циклогексаном. Циклогексан из каждой колбы одновременно переносят в делительные воронки с растворами, после чего колбы сушат 1 мин. [38]
Точно через 10 мин после прибавления раствора железа окисного хлорида измеряют оптическую плотность раствора красновато-оранжевого цвета на спектрофотометре при длине волны 520 нм в кювете с толщиной слоя 10 мм. [39]
Точно через 10 мин после прибавления раствора железа окисного хлорида измеряют оптическую плотность растворов от оранжевого до красновато-оранжевого цвета на спектрофотометре при длине волны 520 нм в кювете с толщиной слоя 10 мм, как указано выше. [40]
Но марганец, выделяясь, уходит в раствор железа, а этот процесс понижает его активность, особенно, если его концентрация в железе достаточно мала. [41]
Реактив составляют добавлением нагретой смеси кислот в раствор двухлористого железа, нагретый до 40 - 50 С. Воду добавляют непосредственно перед употреблением. [42]
В присутствии ферроцианидов должен быть прибавлен избыток раствора железа и жидкость отфильтрована перед титрованием азотнокислым серебром. То же самое применяется и в случае присутствия феррициа-нидов, только сернокислая соль окиси железа заменяется солью закиси. Цианиды также могут быть удалены закисной и окисной солями железа и щелочью с последующим подкислением разбавленной азотной кислотой и фильтрованием. [43]
Сколько граммов железа содержится в 200 мл раствора железа. [44]
Для реакции взято 4 мл 0 0005820М раствора железа и колориметрическая реакция проведена в колбе емкостью 50 мл. [45]
Страницы: 1 2 3 4