Раствор - сильная кислота
Cтраница 3
Щелочность определяют титрованием воды раствором сильной кислоты. Количество раствора, израсходованное до достижения рН 8 3, эквивалентно свободной щелочности; количество, необходимое для достижения рН 4 5, эквивалентно общей щелочности. Если рН воды меньше 4 5, то ее щелочность равна нулю. [31]
Титрование раствора сильного основания раствором сильной кислоты дает точно такую же кривую зависимости рН от количества добавляемой кислоты. Однако в этом случае рН в начале титрования имеет высокие значения, а к концу титрования, наоборот, низкие. [32]
Щелочность определяют титрованием воды раствором сильной кислоты. Количество раствора, израсходованное до достижения рН 8 3, эквивалентно свободной щелочности; количество, необходимое для достижения рН 4 5, эквивалентно общей щелочности. Если рН воды меньше 4 5, то ее щелочность равна нулю. [33]
При галогенировании аминов в растворе сильных кислот наряду с п-изомером получается много и ж-изомера. Объясняется это тем, что в этих условиях галогенированию подвергается не только сам амин, но и его соль. [34]
При галогенировании аминов в растворе сильных кислот наряду с n - изомером получается много и ж-изомера. Объясняется это тем, что в этих условиях галогенированию подвергается не только сам амин, но и его соль. Аммонийная же группа является ж-ориен-тантом ( стр. [35]
При галогенировании аминов в растворе сильных кислот наряду с - изомером получается много и лг-изомера. [36]
Наконец, буферным действием обладают растворы сильных кислот и щелочей, если концентрации их достаточно велики. Конечно, механизм буферного действия тут совершенно иной, чем в рассмотренных ранее случаях. Дело заключается в том, что при большой концентрации кислоты или щелочи в растворе для сколько-нибудь заметного изменения рН раствора нужно и прибавить их сравнительно много. [37]
Наконец, буферным действием обладают растворы сильных кислот и щелочей, если концентрации их достаточно велики. Конечно, механизм буферного действия тут совершенно иной, чем в рассмотренных ранее случаях. Дело в том, что при большой концентрации кислоты или щелочи для сколько-нибудь заметного из - менения рН раствора нужно и прибавить их сравнительно много. [38]
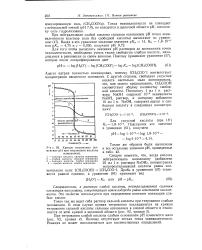 |
Кривые титрования ( изменение рН при титровании кислоты основанием. [39] |
Точно так же ведет себя раствор сильной кислоты при титровании слабым основанием. [40]
Таким образом, если концентрация раствора сильной кислоты выражается единицей, умноженной на 10 с каким-либо показателем степени, рН этой кислоты равняется этому показателю, взятому с обратным знаком. [41]
Таким образом, если концентрация раствора сильной кислоты выражается единицей, умноженной на 10 с каким-либо показате лем степени, рН кислоты равняется этому показателю, взятому с обратным знаком. [42]
Чтобы установить сравнительную меру кислотности растворов сильных кислот или определить силу очень слабых оснований, Гаммет [43, 85] выражал кислотность через степень ионизации ряда индикаторов, являющихся слабыми органическими основаниями. Для установления шкалы кислотности он выбрал группу индикаторов, имеющих одинаковый зарядовый тип и близких по молекулярной структуре, а именно: нитроанилины. Нитроанилины, выбранные в качестве эталонных оснований, являются достаточно сильными, так что термодинамические константы диссоциации их сопряженных кислот ВН в воде могут быть измерены. Соотношение [ В ] / [ ВН ] для этих индикаторов можно измерить вполне надежно в пределах 100-кратного изменения кислотности. Для / г-нитроанилина это соответствует как разбавленным водным растворам сильной кислоты, так и растворам, содержащим до 15 % сильной кислоты. В более кислых растворах соотношение [ В ] / [ ВН ] слишком мало и не может быть измерено с достаточной точностью Более слабое основание о-нитроанилин ( рКа - 0 29) можно применить в том же интервале кислотности, что и л-нитроанилин, а также в растворах более сильных кислот и тоже в пределах 100-кратного изменения кислотности. Интервал кислотности 4-хлор - 2-нитроанилина ( рКа - 1 03) перекрывает интервал о-нитроанилина, и его можно применять с растворами еще более сильных кислот. Выбраны 16 индикаторов из группы нитроанилинов, полностью соответствующие широкому интервалу рН, вплоть до кислотности, равной 100 % - ной серной кислоте, и превосходящие эту кислотность. [43]
По мере увеличения кислотности исследуемых растворов сильных кислот добавляются статистические погрешности при определении величины рКа, обусловливающего выбор данного индикатора, и точность величины Но снижается. [44]
Таким образом, если концентрация раствора сильной кислоты выражается единицей, умноженной на 10 с каким-либо показателем степени, рН этой кислоты равняется этому показателю, взятому с обратным знаком. [45]
Страницы: 1 2 3 4