Раствор - мышьяк
Cтраница 3
Йодные растворы, особенно разведенные, сохраняются продолжительное время в хорошо закупоренных бутылках в прохладном месте, но все же подлежат контролю ежемесячно посредством раствора мышьяка. [31]
Кроме того, кривые потенциометрического титрования подтвердили сделанный нами на основании технологических опытов вывод, что стехиометрическое количество извести по отношению к находящейся в растворе серной кислоте является достаточным для практически полного осаждения из раствора мышьяка и марганца. [33]
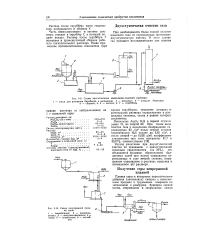 |
Схема приготовления мышьяково-содового раствора.| Схема непрерывной плавки серы. [34] |
Расход реактивов при двухступенчатой очистке по сравнению с одноступенчатой, несколько увеличивается ( на 20 %), что объясняется большим образованием балластных солей при малом содержании сероводорода в газе второй ступени, повышенном содержании в растворе мышьяка и-повышенном рН раствора. [35]
Для приготовления 0 1 N раствора гипосульфита растворяют 25 0 кристаллической соли ( Na2S2J8 5Н30) в дзстиллированной воде до 1 литра, оставляют стоять раствор не менее 8 дней и определяют титр таким же способом, как при растворе мышьяка. [36]
Белый мышьяк получается при обжиге мышьяксодержащих руд. Растворы мышьяка имеют свойства слабой кислоты. Растворимость As203 в холодной воде при 15 1 - 1 6 %, в горячей воде 10 - 10 2 %; при подщелачивании или подкислении среды растворимость повышается. [37]
Титрование всех трех анионов мышьяком ( III) проводят в среде разбавленной НС1 в присутствии обратимого индикатора хинолинового желтого. Титровать следует раствор мышьяка ( III) анализируемым раствором ( содержащим гипобромит, бромит и бромат), так как при подкислении анализируемого раствора, содержащего гипобромит, образуется легколетучий бром. [38]
Для титрования более разбавленных растворов перманганата навеску As2O3 следует уменьшить. При разбавлении раствора мышьяка ( III) аликвотную часть раствора следует отбирать с помощью пипетки и резиновой груши. [39]
Вопрос о присутствии или отсутствии некоторых анионов решается попутно с обнаружением катионов. При отсутствии в растворе мышьяка анионы АзОз и AsO4 присутствовать не могут. Также, не обнаружив в растворе хрома, мы можем утверждать, что в нем отсутствуют анионы СгО4 - - и Сг2О7 - -, поскольку последние в ходе анализа катионов восстанавливаются сероводородом в ионы СГ и, таким образом, попадают в III группу катионов. [40]
Вопрос о присутствии или отсутствии некоторых анионов решается попутно с открытием катионов. При отсутствии в растворе мышьяка анионы AsOjи AsOприсутствовать не могут. Также, не открыв в растворе хрома, мы можем утверждать, что в нем отсутствуют анионы СтО - - и Ст2О - поскольку эти анионы в ходе анализа катионов восстанавливаются сероводородом в ионы Сг и таким образом попадают в III группу катионов. [41]
Отвешивают 7 092 г хорошо смешанной пробы хлорной извести; растирают с небольшим прибавлением воды в фарфоровой ступке, носик которой немного смазан жиром, до получения совершенно равномерной нежной массы, разбавляют большим количеством воды, ополаскивают все в литровую колбу, разбавляют до метки и отсасывают для каждой пробы, хорошо взбалтывая кодбу, 50 мл 0 35i6 г белильной извести в химический стакан. При постоянном взбалтывании приливают щелочной 0 Ш раствор мышьяка ( содержащий 4 918 г As203 в литре - приготовление см. стр. [42]
Израсходованное число миллилитров раствора мышьяка, помноженное на 0 012, должно равняться взятому весу иода. В противном случае вычисляют поправочный множитель для раствора мышьяка обычным способом. [43]
Сейчас же накройте тигель и влажное пятно на бумаге маленькой воронкой с запаянной ( или плотно закрытой комочком ваты) трубкой. Через несколько минут рассмотрите бумагу - почернение ее доказывает присутствие в растворе мышьяка. [44]
Для мышьяковой кислоты ( К 6 - Ю-3, / 2 МО-7, К3 3 - 10 - 12) очень характерна практически нерастворимая в воде шоколадно-бурая соль серебра. Различием цвета Ag3AsO3 и Ag3AsO4 пользуются для установления валентности находящегося в растворе мышьяка. Из солей сурьмяной кислоты ( / ( i 4 - 10 - 5) образованием труднорастворимого Na [ Sb ( OH) 6 ] пользуются в аналитической химии для открытия натрия. [45]
Страницы: 1 2 3 4