Раствор - неэлектролит
Cтраница 1
Растворы неэлектролитов образуют полимеры, не диссоциирующие на ионы, а р астворы электролитов - полимеры, при растворении которых происходит электролитическая диссоциация. [1]
Раствор неэлектролита можно считать разбавленным, еоти концентрация его достаточ-но мала для того, - чтэбы взаимодействием молекул растворенного вещества можно было пренебречь. [2]
 |
Смешиваемость растворителей. [3] |
Растворы неэлектролитов содержат нейтральные молекулы и не обладают электропроводностью, тогда как растворы электролитов ( солей, кислот и оснований) из-за наличия ионов А и В - - хорошие проводники электрического тока. [4]
Растворы неэлектролитов одинаковых молярных концентраций при одинаковых температурах имеют одинаковые осмотические давления. [5]
Обозначим раствор неэлектролита в электролите через А, раствор электролита в неэлектролите через В. [6]
Классифицируя растворы неэлектролитов, принимают во внимание характер межмолекулярных взаимодействий в системе, а именно при-и интенсивность сил притяжения, а также размеры и форму мо-I, передаваемых потенциалом отталкивания. [7]
Обозначим раствор неэлектролита в электролите через А, раствор электролита в неэлектролите через В. [8]
Когда раствор рацемического неэлектролита проходит через колонку ионообменной смолы, вполне можно ожидать, что произойдет частичное разделение, если матрица, фиксированные ио-ногенные группы или обмениваемые ионы будут оптически активными. Так как легче синтезировать неподвижную фазу с асимметрическими атомами обмениваемых ионов, Лейч [195] применял для разделения неэлектролитов дауэкс 50 - Х2 с оптически активными обмениваемыми ионами. [9]
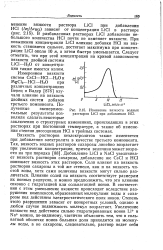 |
Изменение вязкости водных растворов LiCl при добавлении НС1. [10] |
Вязкость растворов неэлектролитов также изменяется при добавлении электролита в качестве третьего компонента. Добавление LiCl и NaCl увеличивает вязкость растворов сахарозы, добавление же CsCl и НС1 понижает вязкость этих растворов. Соли влияют на вязкость растворов сахарозы в той же степени, как и на вязкость чистой воды, хотя сами величины вязкости могут сильно различаться. Влияние солей на вязкость соответствует размерам их ионных радиусов, и можно предположить, что это влияние связано с гидратацией или сольватацией ионов. В соответствии с этим уменьшение вязкости происходит вследствие разрушения комплексов, образованных молекулами воды и сахарозы под действием электростатического поля ионов. Степень этого разрушения зависит от конкретных условий, однако в любом случае подвижность молекул возрастает. [11]
Для растворов неэлектролитов почти отсутствуют прямые указания на проявление специфичности Е адсорбции микропримесей. Растворимость примесей хлоридов и оксихлоридоп меди [35], различных хлоридов и оксихлорида железа [36], алюминия [36], кальция [33] в четырех хлористом кремнии для области температур 25 - 50 С была сопоставлена с величиной адсорбции этих микропримесей из бинарных растворов в очищенном SiCU на особо чистом силикагеле при различных температурах. Между ад сорбируем остью вещества и его растворимостью в данном растворителе установлена прямая зависимость: адсорбируе-мость тем больше, чем меньше растворимость. [12]
Теория растворов неэлектролитов еще более несовершенна, чем теория водных растворов электролитов: предсказание концентрационных и других зависимостей коэффициентов активности компонентов органической фазы для теории растворов неэлектролитов является непосильной задачей. [13]
Для растворов неэлектролитов способы стандартизации основаны на сравнении поведения компонентов реального раствора с их поведением либо в идеальном растворе, либо в предельно разбавленном растворе. [14]
 |
Определение коэффициентов активности при различных способах стандартизации. [15] |
Страницы: 1 2 3 4