Раствор - ниобий
Cтраница 3
Измельченный сплав поступает на водное выщелачивание. Сильно щелочной раствор, содержащий примеси кремния, олова, вольфрама, алюминия, серы, фосфора, отделяют декантацией. Остаток промывают 4 - 5 раз горячим 5 % - ным раствором NaOH для предотвращения перехода в раствор ниобия и тантала. [31]
Измельченный сплав поступает на водное выщелачивание. Сильнощелочной раствор, содержащий примеси Si, Sn, W, Al, S, P, отделяют декантацией. Остаток промывают 4 - 5 раз горячим 5 % - ным раствором NaOH для предотвращения перехода в раствор ниобия и тантала. [32]
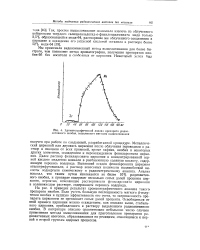 |
Хроматографический анализ препарата радиоактивного ниобия, выделенного методом выщелачивания. [33] |
На рис. 4 приведен результат хроматографического анализа такого препарата ниобия. Если учесть большую поглощаемость мягкого [ 3-излу-чения ниобия и худшую эффективность его счета, то загрязненность препарата цирконием не превышает сотых долей процента. Освободиться от этой примеси циркония можно осаждением, как описано выше, стабильного циркония, прибавленного к раствору выделенного радиоактивного ниобия. В литературе описано сравнительно небольшое число случаев применения метода выщелачивания для приготовления препаратов радиоактивных изотопов, образовавшихся по реакциям, относящимся к первой и второй группам ядерных процессов. [34]
Ниобиевый раствор представляет собой раствор двойного сульфата ниобия и аммония в смеси сульфата аммония и серной кислоты. Известные двойные сульфаты ниобия и аммония в воде растворяются инкогруентно, и растворимая форма их не соответствует составу солей, встреченных нами в сплавах. Состав растворимого двойного сульфата ниобия, свойства которого определяют поведение ниобия в растворе, пока неизвестен. Растворы ниобия в смеси сульфата аммония и серной кислоты могут быть получены из этой соли. [35]
Хотя щавелевокислые комплексы ниобия и тантала были открыты около шестидесяти лет тому назад [1] и их значение в промышленной переработке руд этих металлов, а также при их аналитическом разделении известно, исследованию этих комплексов уделяется чрезвычайно мало внимания. Лишь спустя тридцать лет после открытия оксалатных комплексов ниобия и тантала появляется работа [2], в которой авторы на основании проведенных кондуктометрических и потенциометрических исследований подтверждают факт образования комплексных соединений ниобия и тантала со щавелевой кислотой. В то же время они высказывают предположение, что растворение пятиокисей ниобия и тантала в щавелевой кислоте имеет коллоидный характер. Этими работами в основном и исчерпывается литература, посвященная изучению оксалатных растворов ниобия и тантала. [36]
Сплавляют 0 0715 г чистой пятиокиси ниобия с Зг пиросульфата калия в кварцевом или фарфоровом тигле. Плав растворяют в 1 М винной кислоте и тем же раствором разбавляют до 100 мл. Разбавляя этот раствор 1 М винной кислотой, готовят 0 001 % - или 0 002 % - ный раствор ниобия. [37]
Вопрос об устойчивости сернокислых растворов ниобия и тантала в присутствии титана имеет существенное значение для характеристики способа разделения титана и земельных кислот, описанного нами выше. Эти растворы в присутствии титана подвергаются разложению ( гидролизу) только тогда, когда концентрация сульфата аммония и серной кислоты за счет разбавления водой понижается до 400 г / л и менее. Притом гидролиз Ешступает только при нагревании до кипения. Однако один случай заставил нас заняться специально изучением устойчивости сернокислоаммонийных растворов ниобия и тантала в присутствии титана при комнатной температуре. От одного из опытов осталось некоторое количество раствора следующего состава ( в г / л): МЬ205 - 41.8, Та205 - 2.9, ТЮ2 - 10.2, FeO - 4.92, Fe203 - 2.10, Н2804аит - 403.7, ( NH4) 2S04 - 203.3. Раствор хранился в стеклянной бутыли, закрытой пробкой, при комнатной температуре. [38]
Вопрос об устойчивости сернокислых растворов ниобия и тантала в присутствии титана имеет существенное значение для характеристики способа разделения титана и земельных кислот, описанного нами выше. Эти растворы в присутствии титана подвергаются разложению ( гидролизу) только тогда, когда концентрация сульфата аммония и серной кислоты за счет разбавления водой понижается до 400 г / л и менее. Притом гидролиз Ешступает только при нагревании до кипения. Однако один случай заставил нас заняться специально изучением устойчивости сернокислоаммонийных растворов ниобия и тантала в присутствии титана при комнатной температуре. От одного из опытов осталось некоторое количество раствора следующего состава ( в г / л): МЬ205 - 41.8, Та205 - 2.9, ТЮ2 - 10.2, FeO - 4.92, Fe203 - 2.10, Н2804аит - 403.7, ( NH4) 2S04 - 203.3. Раствор хранился в стеклянной бутыли, закрытой пробкой, при комнатной температуре. Осадок представлял собой мелкокристаллическую фазу, содержащую ниобий, титан, сульфат-ион и ион аммония. Очевидно, раствор ниобия, тантала и титана первоначально был получен в метастабильном состоянии и при стоянии приходил в равновесие. [39]
Страницы: 1 2 3