Раствор - палладий
Cтраница 2
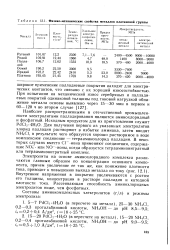 |
Физико-механические свойства металлов платиновой группы. [16] |
Внутренние напряжения в покрытии увеличиваются с ростом его толщины, концентрации в растворе палладия и катодной плотности тока. [17]
Первый титриметрический метод определения палладия описал, видимо, Керстинг [492], который титровал раствор палладия непосредственно иодидом калия до исчезновения коричневой окраски иодида в отстоявшейся жидкости. Этот метод, несомненно, может привести к значительным ошибкам. Пшеницын и Гинзбург [493, 494] титровали палладий иодидом калия потен-циометрически. [18]
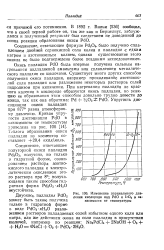 |
Изменение парциального давления кислорода над PdO и 1гО2 в зависимости от температуры. [19] |
Соединение, отвечающее полу горной окиси палладия Pd2O3, получено, но только в гидратной форме, озонированием раствора азотнокислого палладия и электролитическим окислением этого раствора при 8; получающаяся таким способом гид-ратная форма Pd2O3 - xH2O неустойчива. [20]
 |
Схема производства катализатора АПК-2. [21] |
В прямоточный барабанный смеситель 4, снабженный приводом для вращения барабана, загружают освобожденный от серы А12О3 и подают раствор азотнокислого палладия. Количество подаваемой соли определяется содержанием Pd в готовом катализаторе. В процессе пропитки, которая продолжается 1 ч, раствор полностью поглощается носителем. [22]
Цианистый палладий Pd ( CN) 2 представляет собой желтовато-белый желатинозный осадок, образующийся при действии цианидов ртути и калия на растворы палладия; очень слабо растворим в соляной кислоте, легко растворяется в цианиде калия и аммиаке. [23]
Помещают 1 - 2 мл раствора хлорида палладия, содержащего 1 5 - 4 5 мг палладия, в маленький стакан и добавляют раствор иодида калия ( около 0 5 мг соли на 1 мл раствора палладия) Приливают равный объем 2 М соляной кислоты и титруют вишнево-красный раствор стандартным раствором диэтилдитиофосфата до исчезновения коричневой окраски и образования желтой смеси осадка с раствором. [24]
Ниже рассматривается лишь химия палладия и платины. Для опытов; используют раствор палладия в конц. В обоих случаях избыток кислот осторожно удаляют упариванием и затем растворы разбавляют водой до нужной концентрации. [25]
Растворяют 20 г кристаллического сульфата железа ( П) FeSO4 - 7H2O в 100 мл дистиллированной воды, подкисленной несколькими каплями концентрированной серной кислоты. Раствор сульфата железа ( II), применяемый для определения титра иодида калия по раствору палладия, должен быть 15 % - ным ( вес / объем) во избежание восстановления палладия. [26]
Палладий образует два окисла: PdO и PdO2, обладающие характером основных ангидридов, и два ряда солей: соли двухвалентного и четырех-валентного палладия. Соединения четырехвалентного палладия мало устойчивы и обнаруживают стремление к переходу в двухвалентную форму; двуокись палладия отдает половину своего кислорода при слабом нагревании Раствор четыреххлористого палладия, образующийся в виде бурого раствора из двухлористого палладия при пропускании в него хлора, снова отдает присоединенный хлор при выпаривании на водяной бане. Поэтому при анализе большею частью имеют дело с солями двухвалентного палладия. [27]
Из абсорбционных методов определения водорода наиболее точен способ поглощения водорода коллоидным раствором палладия. Для этого две части коллоидного палладия и пять частей пикриновой кислоты, нейтрализованной 22 мл раствора едкого натра, разбавляют водой до 100 мл. Эти 100 мл раствора палладия и пикриновой кислоты способны поглотить 4 л водорода. Поглощение происходит с заметной скоростью и заканчивается через 15 - 20 мин. [28]
В состав электролита, применяемого при электролитическом рафинировании серебра, всегда входит свободная азотная кислота. Присутствие ее увеличивает электропроводность электролита и, соответственно, уменьшает расход электроэнергии. Это ведет к уменьшению катодного выхода по току, повышению расхода азотной кислоты, к ухудшению условий труда в результате загрязнения атмосферы цеха выделяющимися оксидами азота. При повышенной концентрации азотной кислоты значительно увеличивается переход в раствор палладия и платины, а также их осаждение на катоде совместно с серебром. [29]
 |
Схема устройства контрольной трубки. [30] |
Страницы: 1 2 3