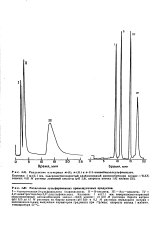
Раствор - борат
Cтраница 2
Колонка: 1 мХ2 1 мм, поверхностно-пористый сильноосновный анионообменник зипакс - SAX; элюент: от 0 01 М раствора бората натрия ( рН 9 2) до 0 1 М раствора по борату натрия ( рН 9 2) и 0 1 М раствора перхлората натрия с экспоненциальным выпуклым характером градиента при 7 % / мин; скорость потока 1 мл / мин, температура 50 С. [17]
Смешивают 75 4 мл раствора углекислого натрия, содержащего 2 65 г безводного химически чистого вещества в 500 мл воды, с 24 6 мл раствора бората натрия, содержащего 9 55 г декагидрата вещества ( Na2B4O7 - 10H2O) в 500 мл воды. [18]
Для реактора SGHWR, введенного в эксплуатацию в 1968 году ( Уинфрит, Англия), разрабатывалась система аварийной остановки, в которой в качестве жидкого поглотителя использовался раствор бората лития. [19]
Обычная борная кислота или ортоборная кислота Н3В03 - чешуйчатые, белые, прозрачные шестигранные пластинки удельного веса 1 46; получается обычно при добавлении соляной или серной кислоты к раствору боратов, чаще всего буры. Она легко кристаллизуется из горячей воды. С водяными парами борная кислота летуча. [20]
Обычная борная кислота или ортоборная кислота Н3В03 - чешуйчатые, белые, прозрачные шестигранные пластинки удельного веса 1 46; получается обычно при добавлении соляной или се рной кислоты к раствору боратов, чаще всего буры. Она легко кристаллизуется из горячей воды. С водяными парами борная кислота летуча. [21]
На окисление гидрохинона влияют добавки фосфатов, боратов и карбонатов щелочных металлов, причем скорость реакции пропорциональна рН и зависит от природы добавляемого вещества, например при рН 8 в растворе бората реакция идет в 13 раз быстрее, чем в растворе фосфата. [22]
Она пропускалась непосредственно через растворы боратов маточные растворы, полученные при производство борной кислс или буры. [23]
 |
Толщина естественного оксидного слоя. [24] |
Одновременно было сделано определение толщины естественного оксидного слоя по емкости электролитических конденсаторов, изготовленных из алюминиевых пластин с естественным оксидным слоем в качестве анода и полос свинцово-оловянной фольги в качестве катода. Электролитом в этих конденсаторах служил раствор бората аммония в смеси этиленгликоля и этилового спирта. [25]
 |
Толщина естественного оксидного слоя. [26] |
Одновременно было сделано определение толщины естественного оксидного слоя по емкости электролитических конденсаторов, изготовленных из алюминиевых пластин с естественным оксидным слоем в качестве анода и полос свинцово-оловянной фольги в качестве катода. Электролитом в этих конденсаторах служил раствор бората аммония в смеси этилен-гликоля и этилового спирта. [27]
Что касается формулы метаборат-иона, то до последнего времени этот вопрос оставался открытым. Только совсем недавно при изучении растворов боратов с помощью спектров комбинационного рассея. [28]
При рН 9 5 достигается максимальное поглощение комплекса. Для создания среды применяют 0 05 М раствор бората. Многие авторы [145, 282, 413, 457, 928, 929] рекомендуют определять магний при рН 8 95 - 9 00, однако при рН 9 оптическая плотность сильно зависит от концентрации этанола и от рН среды. С буферными растворами с рН 11 5 оптическая плотность растворов изменяется при стоянии. При использовании буферных растворов с рН 9 50 - 10 60 ( при концентрации этанола 50 - 60 %) влияние колебаний рН на окраску незначительно; таким образом, указанные значения рН наиболее приемлемы. При использовании маскирующих средств для устранения влияния мешающих элементов необходимо работать при высоких значениях рН, так как при низких рН ( - 9) многие маскирующие вещества неэффективны. [29]
Выбор химической модели, а именно количества реакций и их стехиометрических коэффициентов, может потребовать варьирования не только концентраций реагентов, но и других условий, в первую очередь температуры. Примером является рН - метрическое исследование равновесий в растворах боратов. Несмотря на многолетние исследования, состав полиборат-анионов вызывал постоянные сомнения, путь к разрешению которых был неясен, и изучение таких систем на некоторое время прекратили. При этих исследованиях широко применяли ЭВМ, пытаясь дискриминировать химические модели, в частности, по величине остаточной дисперсии. Лишь недавно [12] были получены новые сведения о составе полиборат-анионов. При этом применялись измерения с водородным электродом в широком диапазоне температур, причем оказалось, что различные частицы лучше всего выявляются в своей температурной области. Из этого примера видна большая роль инициативы химиков, позволяющей в трудных случаях выйти за рамки традиционной области исследований, включить в рассмотрение дополнительный параметр или даже метод исследования. [30]
Страницы: 1 2 3 4