Раствор - соль - бериллий
Cтраница 3
Мы установили, что при действии альфа-пиколина на растворы солей бериллия последний количественно выделяется в форме гидроокиси, которая в условиях, рекомендуемых нами, образуется в достаточно плотной форме и, следовательно, обладает и меньшей адсорбционной способностью. [31]
Нами найдено, что при действии альфа-пиколина на растворы солей бериллия, последний количественно выделяется в форме гидроокиси в плотной форме, обладающей малой адсорбционной способностью. Таким путем бериллий может быть отделен от кальция, стронция, бария, магния и щелочей. [32]
В две пробирки внести поЗ - 4 капли раствора соли бериллия. [33]
В две пробирки внести по 2 - 3 капли раствора соли бериллия. [34]
В две пробирки внести по 3 - 4 капли раствора соли бериллия. [35]
Встречается как полупродукт при получении Be и его Получается из растворов солей бериллия осаждением п Физические и химические свойства. Желатинообразен или старении переходит в кристаллическую форму. Содержит переменное количество воды. При взаимодействии с основаниями образует бериллаты. [36]
Порядок сливания реактивов следующий: нейтральный или слабокислый испытуемый раствор, раствор соли бериллия, раствор морина, вода, раствор едкого кали. Растворы реактивов тщательно перемешивают и переливают в термо-статируемую кювету. Раствор перекиси водорода термостатируют в другой кювете в течение 5 минут. Затем растворы сливают и перемешивают. В момент добавления перекиси водорода включают секундомер и в течение 10 минут через каждую минуту, начиная с первой после добавления перекиси водорода, измеряют интенсивность флуоресценции. [37]
Форма выделяется из растворов бериллатов при кипячении и осаждается аммиаком из растворов солей бериллия при точном соблюдении кислотности, температуры и при введении затравки ранее выделенной гидроокиси. Подобно а-форме трудно растворима в кислотах и щелочах, не поглощает углекислоту и аммиак и почти не сорбирует примеси из растворов. [38]
Гидроокись бериллия Ве ( ОН) 2 осаждается при действии аммиака или сульфида аммония на растворы солей бериллия. Полученный белый аморфный осадок легко растворим в кислотах, едких щелочах и растворах карбонатов щелочных металлов с образованием соответственно бериллата или растворимых карбонатных комплексов. С фторидами натрия и калия образует комплексные соединения, растворимые в воде. [39]
Буферный раствор ( 20 мл 15 % - ного СНзСООМН4) прибавляют к 60 - 70 мл раствора соли бериллия после добавления NH4NO3 и ( NH4) zHAsO4 и нейтрализации его аммиаком до появления неисчезающей мути. Раствор с осадком кипятят в течение 2 - 3 мин. Присутствие комплексона III не влияет на полноту осаждения арсената бериллия. Метод пригоден поэтому для определения бериллия в присутствии мешающих элементов ( см. гл. Авторы рекомендуют растворять осадок в НС1 ( 1: 3) ив этих же условиях титровать иод, выделившийся после добавления KJ. В этом случае более отчетливо выражена точка эквивалентности. Титрование должно осуществляться медленно, чтобы тиосульфат не разлагался. [40]
Гидроокись Be ( ОН) 2 образуется в виде желатиноподобного белого осадка при добавлении едких щелочей к растворам солей бериллия. Нерастворима в аммиаке, но растворяется в едких щелочах, карбонатах щелочных металлов и карбонате аммония. [41]
Буферный раствор ( 20 мл 15 % - ного СНзСО ( ЖН4) прибавляют к 60 - 70 мл раствора соли бериллия после добавления NH4NO3 и ( NH4) 2HAsO4 и нейтрализации его аммиаком до появления неисчезающей мути. Раствор с осадком кипятят в течение 2 - 3 мин. Присутствие комплексона III не влияет на полноту осаждения арсената бериллия. Метод пригоден поэтому для определения бериллия в присутствии мешающих элементов ( см. гл. Авторы рекомендуют растворять осадок в НС1 ( 1: 3) ив этих же условиях титровать иод, выделившийся после добавления KJ. В этом случае более отчетливо выражена точка эквивалентности. Титрование должно осуществляться медленно, чтобы тиосульфат не разлагался. [42]
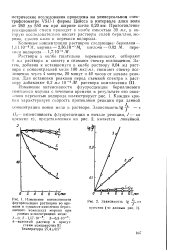 |
Изменение интенсивности флуоресценции растворов во времени в процессе окисления бериллиевого комплекса морина при.| Зависимость lg 2 от времени ( по данным 1. [43] |
Цейсса в интервале длин волн от 260 до 550 нм при ширине щели 0 20 мм - Приготовление реакционной смеси проводят в колбе емкостью 30 мл, в которую последовательно вводят растворы солей бериллия, мо-рина, едкого кали и перекиси водорода. [44]
Страницы: 1 2 3