Раствор - соль - цирконий
Cтраница 3
Сульфат калия, прибавленный в виде концентрированного раствора к раствору соли циркония, дает характерный осадок KzSCVZi SOJz, нерастворимый в избытке осадителя, но растворимый в разбавленной соляной кислоте. Осадок, полученный при нагревании, труднее растворим. Соответствующие соли натрия и аммония, в отличие от солей калия, растворимы. [31]
Другие авторы [505] для растворения осадка LaF3 обрабатывают его раствором соли циркония. Присутствие циркония увеличивает растворимость LaFs и делает присутствующий Pu ( IV) более легко окисляемым до шестивалентного состояния. [32]
Осаждение проводилось обычно при быстром приливании раствора фосфорной кислоты к раствору соли циркония при комнатной температуре ( 18 - 20 С) и сопровождалось интенсивным перемешиванием. Отдельными опытами было установлено, что порядок и скорость сливания реагентов не оказывают влияния на состав получаемого осадка. После осаждения осадки с раствором оставлялись на ночь для отстаивания, отфильтровывались, промывались на фильтре водой до отрицательной качественной реакции в фильтрате на анион, взятый для осаждения соли циркония, и сушились в течение 8 час. [33]
Гидроокись циркония Zr ( OH) 4 - белый осадок, выпадает из 0 01 М растворов солей циркония при рН2, не растворима в избытке щелочи, образует коллоидные растворы. Гидроокись циркония, подобно титану и олову, образует две модификации: z - Zr ( OH) 4 - легко растворимую в кислотах и ( 3 - ZrO ( OH) 2 - нерастворимую в минеральных кислотах. Первая получается при действии щелочи на раствор соли циркония на холоду, вторая - при нагревании. [34]
Гидроокись циркония Zr ( OH) 4 - белый осадок, выпадает из 0 01 М растворов солей циркония при рН2, не растворима в избытке щелочи, образует коллоидные растворы. Гидроокись циркония, подобно титану и олову, образует две модификации: a - Zr ( OH) 4 - легко растворимую в кислотах и - ZrO ( OH) 2 - нерастворимую в минеральных кислотах. Первая получается при действии щелочи на раствор соли циркония на холоду, вторая - при нагревании. [35]
При содержании в 1 мл раствора 1 ч фтора красно-фиолетовая смесь 2 мл 1 % - ного раствора соли циркония и 5 мл 0 3 % - но-го раствора ализаринсульфокислоты в 60 мл концентрированной соляной кислоты окрашивается в желтый цвет. При увеличении количества соляной кислоты реакция становится более чувствительной. [36]
При содержании в 1 мл раствора 1 i фтора красно-фиолетовая смесь 2 мл 1 % - ного раствора соли циркония и 5 мл 0 3 % - но-го раствора ализаринсульфокислоты в 60 мл концентрированной соляной кислоты окрашивается в желтый цвет. При увеличении количества соляной кислоты реакция становится более чувствительной. [37]
В другую такую же склянку наливают из мерного цилиндра 40 мл раствора-свидетеля и титруют жидкость в первой склянке раствором соли циркония, пока ее окраска не станет близкой к окраске раствора-свидетеля. [38]
Купферонаты гафния и циркония - малорастворимые соединения ( табл. 98) и выпадают в осадок при добавлении избытка купферона к растворам солей циркония и гафния. [39]
Описано титрование раствором нитрата церия ( III) в присутствии метилового красного и других индикаторов [1-4] ( методика № 28), раствором нитрата урана, иттрия [2, 5, 6], растворами соли циркония ( методика № 88) в присутствии ализаринового красного S [7-14] для микроопределения фтор-иона. [40]
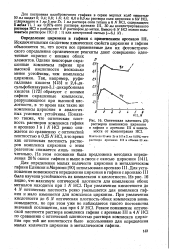 |
Оптическая плотность (. растворов комплексов циркония и гафния с арсеназо III в зависимости от концентрации НС1. [41] |
Для построения калибровочного графика в серию мерных колб емкосты 50 мл вводят 0; 0 4; 0 8; 1 6; 4 0; 6 0 и 8 0 мл раствора соли циркония в 6ЛГ НС1, содержащего в 1 мл 5 мкг Zr, 1 мл раствора соли титана вб N НС1, содержащего1 Sta / MATi. III, 30мл концентрированного раствора НС1 и разбавляют 6 N раствором до метки. [42]
К анализируемому раствору добавляют по 10 мг носителей Y, Tb, Eu, Sm и Nd в 20 мл 2 М НС1 ( HNO3 или НС1О4), затем вносят 3 капли раствора соли циркония с концентрацией 10мг2г / мл, 20мл 3 М НС1 и 5 капель конц. Фильтрат переносят в полиэтиленовый или плексигласовый стакан, добавляют 2 мл 1 5 М раствора К2СЮ4 и 0 5 мл конц. HF и растворяют в 3 мл конц. Добавляют 5 капель растбора соли бария, 1 мл 6 М H2SO4, разбавляют до 20 мл водой, нагревают на водяной бане 5 мин. Фильтрат подщелачивают до рН 7 при помощи конц. КШОН, нагревают несколько минут и центрифугируют осадок гидроокисей. После промывания осадка раствором NH4OH его растворяют в 4 мл конц. А-1 ( 50 - 100 меш), предварительно обработанную 5 мл конц. [43]
К анализируемому раствору добавляют по 10 мг носителей Y, Tb, Eu, Sm и Nd в 20 мл 2 М НС1 ( НМОз или НС1О4), затем вносят 3 капли раствора соли циркония с концентрацией 10 мг 2т / мл, 20 мл 3 М НС1 и 5 капель конц. Фильтрат переносят в полиэтиленовый или плексигласовый стакан, добавляют 2 мл 1 5 М раствора К2 & О4 и 0 5 мл конц. HF и растворяют в 3 мл конц. Добавляют 5 капель раствора соли бария, 1 мл 6 М Ш5О4, разбавляют до 20 мл водой, нагревают на водяной бане 5 мин. Фильтрат подщелачивают до рН) 7 при помощи конц. МШОН, нагревают несколько минут и центрифугируют осадок гидроокисей. После промывания осадка раствором МНдОН его растворяют в 4 мл конц. А-1 ( 50 - 100 меш), предварительно обработанную 5 мл конц. [44]
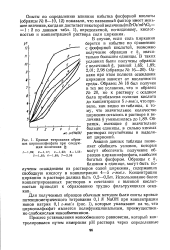 |
Кривые титрования образцов цирконилфосфата при следующих величинах &. [45] |
Страницы: 1 2 3 4