Раствор - уранилнитрат
Cтраница 3
Наиболее обычным конечным процессом является осаждение урана из раствора уранилнитрата. Он обычно осуществляется путем добавления в раствор аммиака, не содержащего карбоната. При этом получается осадок, называемый диуранатом аммония; его химическая природа неясна и аммиак здесь может быть адсорбированным или окклюдированным. Кроме этого, уран при надлежащей кислотности может быть осажден в виде пероксида. После сушки и прокаливания до окиси продукт обрабатывают неводными методами, обычно заканчивающимися кальцийтермическим восстановлением фторида до металла. [31]
Активный слой наносится па подложку электролитическим способом из раствора уранилнитрата в. Химический состав активного слоя - окислы урана. [32]
Пант и Канделвал отмечали, что спектры флуоресценции растворов уранилнитрата содержат несколько серий полос, исчезающих и появляющихся вместе, причем существование четырех из них четко доказано. [33]
Спектр его ( рис. 2.33) подобен спектру раствора шестиводного уранилнитрата в диоксане. Добавление NBu4NO3 заметно увеличивает растворимость, а образующийся раствор имеет спектр того же типа, что и сильно закомплексованные кетонные растворы. [34]
Третьяк [77] пришли к выводу, что в растворах уранилнитрата концентрации 4 - Ю-3 М уранилнитратные комплексы либо отсутствуют вообще, либо находятся в ничтожных количествах, которые не могут быть определены по изменению оптической плотности. [35]
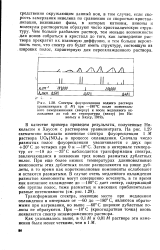
Питание первой колонки ( рис. 20) представляет собой раствор уранилнитрата с недостатком кислоты, содержащей плутоний и продукты деления. Недостаток кислотности создается частичной нейтрализацией кислоты, выделяющейся при гидролизе уранилнитрата. [36]
Бейн [49] выделил малые количества тория из 0.15 Л4 раствора уранилнитрата в 0 1 М HNO3 при прохождении раствора через колонку из смолы амберлит IR-1. Колонка была тщательно промыта 0 25 М H2SO4 для полного удаления урана. [37]
Шуберт и Конн [30] определили коэффициент диффузии Zr95 в растворе уранилнитрата. [38]
 |
Электрофорез азотнокислых растворов Zr05. [39] |
Шуберт и Конн [29] определили коэффициент диффузии Zr96 в растворе уранилнитрата. Возможно, величина коэффициентов диффузии была завышена из-за адсорбции Zr95 на стеклянной пористой мембране. В 0.48 и 1.2 м U02 ( N03) 2 радиус частиц Zr95, вычисленный по уравнению Эйнштейна-Стокса, составил примерно 0.8 - 1.0 тц. [40]
Для приготовления эталонных растворов в кварцевые стаканчики отбирают такие порции раствора уранилнитрата, чтобы содержание в них урана было равным содержанию в аликвотной части пробы, и прибавляют столько стандартного раствора алюминия ( Б), чтобы содержание алюминия в них соответствовало содержанию последнего в пробе. Далее обработка аналогична обработке аликвотной части. [41]
Шуберт и Кон [ S99 ] нашли, что в полумолярном растворе уранилнитрата ( при его рН), содержащем большинство продуктов деления ( свободных от носителя), только радиоактивные изотопы циркония и ниобия не диализуются полностью. Это в достаточной степени свидетельствует о том, что измеримые доли радиоактивных индикаторов - циркония и ниобия - находятся в виде радиоколлоидов, тогда как другие продукты деления находятся в виде ионов или молекул. Добавление серной или азотной кислоты увеличивает долю извлекаемых диализом циркония и ниобия. Присутствие сульфата натрия увеличивает долю извлекаемого диализом ниобия, тогда как в присутствии нитрата натрия этого не наблюдается. Добавление сульфата или нитрата натрия несколько уменьшает долю извлекаемого диализом циркония. [42]
На рис. 43 приведены спектры излучения ( - 190 С) раствора уранилнитрата, раствора урана той же концентрации, но содержащего высаливатель - NaNO3, и органического экстракта урана. [43]
В качестве примера приведем результаты, полученные Ни-кольсом и Хаусом с растворами уранилнитрата. Сначала число размытых полос флуоресценции увеличивается с двух при 20 С до четырех при 0 и - 18 С. Затем в интервале температур от - 18 до - 25 С наблюдается трансформация спектра, заключающаяся в появлении трех новых размытых дублетных полос. При еще более низких температурах длинноволновые компоненты этих дублетных полос расщепляются на узкие дублеты, в то время как коротковолновые компоненты ослабевают и остаются размытыми. [45]
Страницы: 1 2 3 4