Раствор - фенол
Cтраница 3
Добавление в раствор фенола, являющегося донором протонов, приводит к увеличению первой волны до двухэлектронной, и электродный процесс становится необратимым. В результате этого процесса возникает монокарбонильное производное, которое восстанавливается при более отрицательных потенциалах. Иначе протекает восстановление ди-бензоилэтилена и диметилфумарата, дающих на полярограммах три волны, из которых вторая меньше первой ( одноэлектронной) и падает при уменьшении периода капания. Добавленные в раствор доноры протонов почти не взаимодействуют с анион-радикалами, возникающими при потенциалах первой волны. [31]
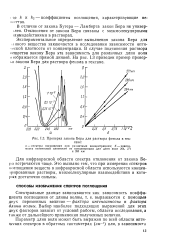 |
Проверка закона Бера для раствора фенола в гек. [32] |
Бера для раствора фенола в гексане. [33]
В случае растворов фенола расчет по уравнению ( 86) удовлетворительно согласуется с экспериментальными данными ( рис. 22), хотя согласие между рассчитанными и опытными С, - кривыми здесь хуже, чем в случае алифатических соединений. Этот эффект, по-видимому, обусловлен я-электронньш взаимодействием между молекулами С6Н5ОН и поверхностью ртути. [34]
Проведено хлорирование растворов фенола различной ( 20 - 90 %) концентрации в нитрометане. [35]
Точное количество раствора фенола помещают в мерную колбу, доводят объем дистиллированной водой до метки и тщательно перемешивают. Приливают 50 см3 бромидброматного раствора ( содержащего 5 939 г КВг и 1 666 г КВг2О3 в 1 дм3 воды), 5 см3 концентрированной H2SO4 и встряхивают. Параллельно ставится контрольный опыт, в котором вместо фенола добавляется такое же количество дистиллированной воды. [36]
Точное количество раствора фенола помещают в мерную колбу вместимостью 100 см3, доводят объем раствора дистиллированной водой до метки и тщательно перемешивают. Приливают 50 см3 бромидброматного раствора ( содержащего 5 939 г КВг и 1 666 г КВг2О3 в 1 дм3 воды), 5 см3 концентрированной H2SC4 и встряхивают. Параллельно ставится контрольный опыт, в котором вместо фенола добавляется такое же количество дистиллированной воды. [37]
При взаимодействии раствора фенола в бензоле массой 200 г с избытком бромной воды получили бромпроизводное массой 66 2 г. Определите массовую долю фенола в растворе. [38]
При взаимодействии раствора фенола в бензоле массой 200 г с избытком бромной воды получили бромпро-изводное массой 66 2 г. Определите массовую долю фенола в растворе. [39]
При встряхивании раствора фенола в водном NaOH с хлорангидридом бензойной кислоты выпадает белый осадок. [40]
Если к раствору фенола и фурфурола добавляют конц. Одновременно она разогревается и образуются черные твердые продукты, нерастворимые в этаноле, хлороформе, ацетоне и бензоле, стойкие к действию щелочей и кислот. Они эластичны, а по твердости сходны с резитами. [41]
Прибавление к раствору фенола капли раствора хлорного железа FeClg вызывает появление фиолетового окрашивания. Эта реакция служит для обнаружения фенола. [42]
Изобутилен пропускают через раствор фенола в четыреххлористом углероде, содержащий суспензию хлористого алюминия и небольшое количество третичного хлористого бутила. Реакция протекает через промежуточное образование хлористого алкила; выделяющийся при этом хлористый водород присоединяется к изобутилену с образованием такой же молекулы хлористого алкила, вновь вступающего в реакцию. [43]
Действием серы на раствор фенола в глицерине Е присутствии соды при 120е получают л - диоксидифенилдисульфид, а при 180 - я - диоксидифенилсульфид. Сульфиды фенолов - резко выраженные кислотные соединения; они выделяют СОг из карбонатов щелочных и щелочноземельных металлов. [44]
В цилиндр наливают раствор фенола и щелочи, затем прибавляю охлажденный раствор д-нитроанилина в соляной кислоте; тотчас ж появляется красное окрашивание. [45]
Страницы: 1 2 3 4