Раствор - слабый электролит
Cтраница 3
Свойства растворов слабых электролитов объясняются простым увеличением числа частиц из-за диссоциации молекул на ионы. В случае полностью диссоциированных сильных электролитов это объяснение недостаточно, что вытекает из следующих фактов. Разбавленные растворы типично сильного электролита NaCl, где число частиц при диссоциации удваивается ( а1, г2), должны были бы обнаруживать и вдвое большие изменения температур кипения и замерзания, чем растворы неэлектролитов той же концентрации. Опыт, однако, показывает, что величины А7К и АГ3 меньше ожидаемых. [31]
Для растворов слабых электролитов i равно отношению фактического числа частиц растворенного вещества в растворе к тому числу частиц, которое было бы при отсутствии диссоциации. [32]
Для растворов слабых электролитов зависимость 1 / Л от произведения Лс в первом приближении линейна, а наклон прямой линии равен 1 / Л 2 / Сс. [33]
Активность растворов слабых электролитов может быть представлена произведением концентрации на коэффициент активности: Cfc. [34]
Для растворов слабых электролитов коэффициент электропроводности / я близок к единице и отношение электропроводностей будет отвечать степени диссоциации. [35]
Для растворов слабых электролитов коэффициент электропроводности f близок к единице и отношение электропроводностей будет отвечать степени диссоциации. [36]
Для растворов слабых электролитов коэффициент электропроводности / А близок к единице и отношение электропроводностей соответствует степени диссоциации. [37]
К растворам слабых электролитов, как к равноосным гомогенным системам, приложим закон действующих ласе. [38]
К растворам слабых электролитов, как к равновесным гомэгенным системам, приложим закон действия масс, на основе которого может быть выведена константа равновесия в указанных системах. [39]
К растворам слабых электролитов, как к равновесным гомогенным системам, приложим закон действия масс, на основе которого может быть выведена константа равновесия. [40]
В растворах слабых электролитов величину рН можно находить, не учитывая активностей, так как ионная сила в этих растворах очень мала и коэффициент активности близок к единице. [41]
В растворах слабых электролитов в присутствии посторонж солей ионная сила может быть значительной, и для получен. [42]
 |
Схема образования ионной пары. [43] |
В растворе слабых электролитов ( а - С 1) можно говорить о равновесии между ионами и реально существующими недиссоциированными молекулами. [44]
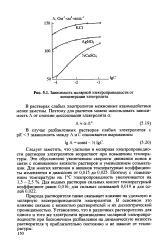 |
Зависимость молярной электропроводности от концентрации электролита. [45] |
Страницы: 1 2 3 4