Раствор - гидроокись - литий
Cтраница 2
Соединение LIKO2 Н2ОЯ ЗН2О получается R виде; мелких бес-диетных кристаллоп при добавлении болыиого количества спирта-к раствору гидроокиси лития и перекиси водорода. Еез При длительном стоянии над фосфорным ангидридом is паку уме образуется LisO2 с незначительным содержанием влаги. [16]
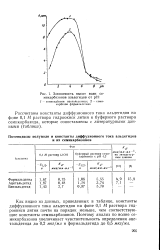 |
Зависимость высот волн семикарбазонов альдегидов от рН. [17] |
Как видно из данных, приведенных в таблице, константы диффузионного тока альдегидов на фоне 0 1 М раствора гидроокиси лития почти на порядок меньше, чем соответствующие константы семикарбазонов. Поэтому анализ по волне семикарбазонов увеличивает чувствительность определения ацетальдегида до 0 2 мкг / мл и формальдегида до 0 5 мкг / мл. [18]
Метод основан на восстановлении формальдегида до мета-иола при потенциале полуволны от - 1 75 до-1 77 В на ртутно-капельном электроде на фоне О IN раствора гидроокиси лития. Определение проводят по калибровочной кривой, получаемой по дифференциальным подпрограммам. [19]
В табл. 83 приведены значения у при 25, полученные этим методом - Экстраполяция может быть выполнена удовлетворительно для всех растворов гидроокисей, кроме растворов гидроокиси лития, для которых получаются сравнительно неточные результаты. [20]
При сравнении делигнифицирующей способности едкого кали, едкого натра и гидроокиси лития оказалось, что наибольшей делигнифицирующей способностью обладают растворы едкого кали, а наименьшей - растворы гидроокиси лития. При 2 9 - 4 5-молярных концентрациях различие в активности сказывается незначительно. С увеличением концентрации оно проявляется в большей степени. [21]
В работе [324] для дегидрокрекинга - гексадекана использованы сульфидные ( NiS) и окисные ( NiO) катализаторы на носителе ( силикагель), которые предварительно обрабатывались растворами гидроокиси лития различной концентрации с целью подавления их изомеризующей активности по отношению X двойной связи и увеличения выхода а-олефинов. [22]
Сняты полярограммы на фонах 1 М и 0 1 М растворов гидроокиси лития и едкого кали и 0 1 М растворов хлористого лития и хлористого натрия и показано, что волны альдегидов хорошо выражены и имеют большие диффузионные токи на фоне 0 1 М раствора гидроокиси лития. [23]
В четыре мерных колбы емкостью по 25 мл помещают по 1, 2, 3, 4 мл этого раствора, разбавляют приблизительно до половины колб 40 % - ным этиловым спиртом, добавляют по 1 мл 0 5 % - ного раствора желатины и доливают до метки 0 2 М раствором гидроокиси лития. По 15 мл каждого раствора помещают поочередно в электролизер и снимают подпрограммы. [24]
В четыре мерных колбы емкостью по 25 мл помещают по 1, 2, 3, 4 мл этого раствора, разбавляют приблизительно до половины колбы 40 % - ным этиловым спиртом, добавляют по 1 мл 0 05 % - ного раствора желатины и доливают до метки 0 2 М раствором гидроокиси лития. По 15 мл каждого раствора помещают поочередно в электролизер и снимают подпрограммы. [25]
Порошкообразный пентаацетат р-о-глюкопиранозы ( 5 г, 12 8 ммоль) обрабатывают фосфорной кислотой, как описано выше, только время обработки сокращают до 5 мин. Смесь быстро охлаждают и обрабатывают раствором гидроокиси лития. [26]
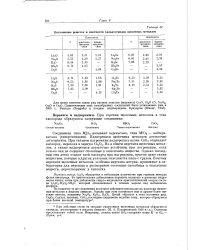 |
Постоянные решеток и плотности халькогенидов щелочных металлов. [27] |
Перекись лития Li202 образуется в небольшом количестве при горении металла в ] токе кислорода. Ее приготовляют добавлением перекиси водорода к раствору гидроокиси лития; затем при добавлении спирта выделяется кристаллический осадок состава Li2O2 - H2O2 - 3H2O, который обезвоживают в течение недели над пятиокисью фосфора. [28]
Перекись лития Li202 образуется в небольшом количестве при горении металла в токе кислорода. Ее приготовляют добавлением перекиси водорода к раствору гидроокиси лития; затем при добавлении спирта выделяется кристаллический осадок состава Li202 - H202 - 3H20, который обезвоживают в течение недели над пятиокисыо фосфора. [29]
На капельном ртутном электроде в щелочной среде формальдегид восстанавливается до метилового спирта. Для анализа формалина пробу его разбавляют этиловым спиртом, добавляют раствор гидроокиси лития и снимают полярограмму приготовленного раствора. Параллельно готовят серию растворов с разным содержанием формальдегида, снимают их полярограммы, строят калибровочную кривую и по ней находят содержание формальдегида в анализируемом образце. [30]
Страницы: 1 2 3