Атермальный раствор
Cтраница 2
Примерами атермальных растворов могут служить ге-гексан и и-гептан, хлористый этил и бромистый этил, к-бутплхлорид и к-бутилбромпд. [16]
Сами же строго атермальные растворы при значительном или большом различии в молекулярных объемах ( в величине молекул компонентов) и при практическом допущении хаоса в объемном распределении молекул сильно отличаются от обычных идеальных растворов. Для высокополимеров мы наблюдаем большие отрицательные отклонения от идеальности. Различия в объемах компонентов в 2 - 4 раза уже вызывают существенные отрицательные отклонения в растворах, формально близких к идеальным. [17]
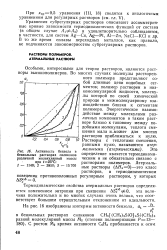 |
Активность бензола в. [18] |
Термодинамические свойства атермальных растворов определяются изменением энтропии при смешении AS 3 0 эта величина положительна и во многих случаях очень велика, что соответствует большим отрицательным отклонениям от идеальности. [19]
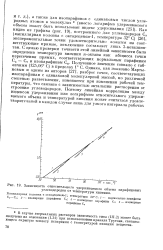 |
Зависимость относительного удерживаемого объема парафиновых. [20] |
В случае атермальных растворов зависимость типа (III.2) может быть получена на основании (1.31) при использовании правила Трутона, связывающего скрытую теплоту испарения с температурой кипения вещества. [21]
Естественно, что для атермальных растворов наклон прямой на графике логарифм характеристики удерживания - обратная абсолютная температура колонки - определяется лишь температурной зависимостью упругости насыщенного пара сорбата [1] и, таким образом, системам, включающим один и тот же сорбат ( но различные неподвижные фазы), отвечают параллельные прямые, расстояние между которыми равно логарифму энтропийной составляющей коэффициента активности. [22]
Таким образом, в случае атермальных растворов даже при очень малой мольной доле добавки отклонения от закона Рауля могут быть очень велики. [23]
Третий частный случай связан с образованием атермальных растворов. Этот класс растворов образуется без изменения энтальпии, когда Д / 0, но за счет разности в размерах молекул растворителя и растворяемого компонента изменение энтропии составляет заметную величину. [24]
 |
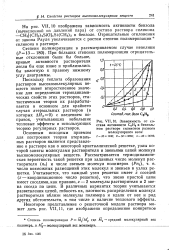
Теоретические ( линии и экспериментальные ( кружки значения коэффициента активности бензола в растворах бензол ( 1 - дифенилметан и бензол ( 1 - дибензил. [25] |
Здесь роль различия в объемах для атермальных растворов и роль различия во взаимных энергиях для поправки на не-атермальность конкурируют. [26]
 |
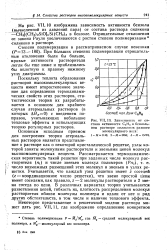
Зависимость от состава активности С6Н8 в бензольном растворе силиконов разного молекулярного веса. [27] |
Основным исходным приемом для построения теории атермальных растворов является представление о растворе как о некоторой кристаллической решетке, узлы которой заняты молекулами растворителя и звеньями цепей молекул высокомолекулярных веществ. Учитывается, что каждый узел решетки имеет z соседей ( г - координационное число решетки), что звено простой цепи имеет соседями, как правило, г - 2 молекулы растворителя и 2 звена соседа по цепи. В различных вариантах теории учитываются разветвления цепей, гибкость их, плотность распределения молекул растворителя вблизи молекулы полимера и вдали от нее и ряд других обстоятельств, в том числе и наличие теплового эффекта. [28]
 |
Зависимость от состава активности С3Н6 в бензольном растворе силиконов разного. [29] |
Основным исходным приемом для построения теории атермальных растворов является представление о растворе как о некоторой кристаллической решетке, узлы которой заняты молекулами растворителя и звеньями цепей молекул высокомолекулярных веществ. Учитывается, что каждый узел решетки имеет г соседей ( г - координационное число решетки), что звено простой цепи имеет соседями, как правило, г - 2 молекулы растворителя и 2 звена соседа по цепи. В различных вариантах теории учитываются разветвления цепей, гибкость их, плотность распределения молекул растворителя вблизи молекулы полимера и вдали от нее и ряд других обстоятельств, в том числе и наличие теплового эффекта. [30]
Страницы: 1 2 3 4