Атермальный раствор
Cтраница 3
Третий частный случай связан с образованием атермальных растворов. Этот класс растворов образуется без изменения энтальпии, когда Д / 0, но за счет разности в размерах молекул растворителя и растворяемого компонента изменение энтропии составляет заметную величину. [31]
Следовательно, представление закиси железа как атермального раствора [66, 87-90, 92-94] реально существующих или гипотетических окислов железа неверно ( см. табл. V. [33]
Флори - Хаг-гинса, равный нулю для атермальных растворов и принимающий значение 1 / 2 для тэта-растворителей, z - координационное число в отсутствие адсорбции. [34]
Естественно, что применение такого метода ограничено лишь атермальными растворами. [35]
В табл. 6 даны величины - Igyi в атермальных растворах ди -, три - и тетрамеров в мономере, рассчитанные по теории атермальных растворов с различными предположениями о величине координационного числа. [36]
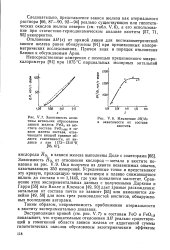
 |
Теоретические ( линии и экспериментальные ( кружки значения коэффициента активности бензола в растворах бензол ( 1 - дифенилметан и бензол ( 1 - дибензил. [37] |
Основы теории регулярных и строгорегулярных растворов, а также теории атермальных растворов строятся в предположении отсутствия изменения объема при образЬвании раствора. Роль объемного фактора обычно признается незначительной. Попытка оценить связь изменения объема с термодинамическими свойствами раствора была сделана Скэтчардом в 1937 г. в применении к регулярным растворам. [38]
В ряде случаев изложенный выше метод оказывается полезным для конкретных расчетов изотерм сорбции атермальных растворов. В качестве примера на рис. 1 1 приведены теоретическая кривая, рассчитанная по изложенному выше методу, и экспериментальные данные, представляющие зависимость давления паров бензола над бензольными растворами каучука. [40]
Используя формулы (2.3.19), (2.3.20), (2.3.33), можно найти избыточную свободную энергию РЕ атермального раствора, а также величину ФЕ, что позволяет с учетом (2.3.30) и (2.3.32) получить явный вид уравнения изотермы. [41]
В табл. 6 даны величины - Igyi в атермальных растворах ди -, три - и тетрамеров в мономере, рассчитанные по теории атермальных растворов с различными предположениями о величине координационного числа. [42]
Даже при небольших значениях ш возможны положительные отклонения свойств раствора, которые могут компенсировать, а иногда и превысить отрицательные отклонения, присущие чисто атермальным растворам. [43]
С момента возникновения первых представлений об идеальных растворах было предложено немало других, более совершенных моделей растворов, например, модель регулярного раствора, модель атермального раствора, модель разбавленного раствора сильных электролитов и другие. Их обсуждение не входит в задачу настоящей книги. Отметим только, что каждая из них относится к довольно узкому классу растворов и далека от того, чтобы претендовать на высокую общность. [44]
Поскольку теплота образования растворов высокомолекулярных веществ имеет второстепенное значение для определения термодинамических свойств этих растворов, статистическая теория их разрабатывается в основном для крайнего случая атермальных растворов ( в которых АЯР0) с введением поправок, учитывающих небольшие тепловые эффекты и использующих теорию регулярных растворов. [45]
Страницы: 1 2 3 4