Реальный раствор
Cтраница 2
Реальные растворы имеют положительные или отрицательные отклонения от законов Рауля и Дальтона. [16]
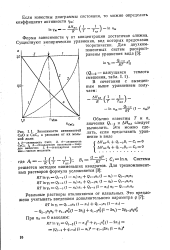 |
Зависимости активностей СаО и СаС2 в расплаве от их мольной доли. [17] |
Реальные растворы отклоняются от идеальных. [18]
Реальные растворы не подчиняются законам идеальных растворов. [19]
Реальные растворы, как правило, отклоняются от идеального поведения. Согласно химической точке зрения, развитой Долезалеком ( 1908 г.), эти отклонения лишь кажущиеся и обусловлены тем, что истинный состав раствора неизвестен. Так, если при смешении компонентов образуются соль-ваты, то истинные мольные доли компонентов в растворе меньше соответствующих значений по приготовлению, в результате наблюдаются отрицательные отклонения от закона Рауля. [20]
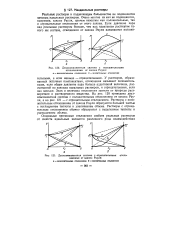 |
Двухкомпонентная система с положительными.| Двухкомпонентная система с отрицательными отклонениями от закона Рауля. - незначительные отклонения. б - значительные отклонения. [21] |
Реальные растворы в подавляющем большинстве не подчиняются законам идеальных растворов. Очень многие из них не подчиняются, например, закону Рауля, причем известны как положительные, так и отрицательные отклонения от этого закона. [22]
Реальные растворы не обладают этими термодинамическими свойствами. [23]
Реальные растворы так же, как и идеальные, характеризуются неупорядоченной структурой, но, в отличие от идеальных, несколько отклоняются от закона Рауля. [24]
Реальные растворы в концентрации 1 т дают заметные отклонения от предсказанного осмотического давления, подобно тому как это имеет место при вычислении точек замерзания и точек кипения. [25]
Реальные растворы не подчиняются законам идеальных растворов. Отклонения могут быть как положительными, так и отрицательными. Если давление пара над реальным раствором больше, чем над идеальным раствором такого же состава, отклонение от закона Рауля называют положительным, а если меньше - отрицательным. [26]
Реальные растворы, вообще говоря, не обладают этими свойствами и для них не соблюдается закон Рауля. На рис. V.8 и V.9 представлены зависимости давления пара от состава для двух реальных растворов. Прямые штриховые линии соответствуют давлению пара, которое наблюдалось, если бы растворы были совершенными. На рис. V.8 показаны положительные отклонения, при которых давление пара выше, чем для совершенного раствора такой же концентрации, а на рис. V.9 - отрицательные отклонения, где давление пара меньше, чем для совершенного раствора. [27]
Реальные растворы, характеризующиеся положительными отклонениями давления пара, образуются из чистых компонентов большей частью с поглощением теплоты. [28]
Реальные растворы, характеризующиеся отрицательными отклонениями давления пара, образуются из чистых компонентов обычно с выделением теплоты. [29]
Реальные растворы, вообще говоря, не подчиняются закону Рауля. Прямые штриховые линии показывают величины давления для совершенных растворов. [30]
Страницы: 1 2 3 4