Реальный раствор
Cтраница 3
Реальные растворы, вообще говоря, не обладают этими свойствами и для них не соблюдается закон Рауля. На рис. V.8 и V.9 представлены зависимости давления пара от состава для двух реальных растворов. [32]
Реальные растворы жидкостей по своим свойствам лишь в большей или меньшей степени приближаются к идеальному раствору, ибо не существует двух жидкостей, молекулярные силовые поля которых в точности одинаковы. [33]
Реальные растворы расплавленных солей образуются с расширением или сжатием; в отдельных случаях наблюдаются положительно-отрицательные отклонения от идеального поведения. [34]
 |
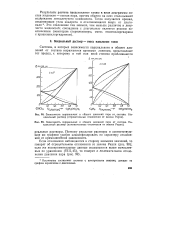
Зависимость химического потенциала компонента к от логарифма его мольной доли в совершенном ( 1 и реальном ( 2 растворах ( / к - интервал значений. [35] |
Если реальный раствор является разбавленным, то для выражения зависимостей химических потенциалов компонентов от состава раствора могут быть использованы кроме Л - шкалы другие концентрационные шкалы. Переход к новым переменным осуществляется путем замены с помощью соотношений (2.13.10) или (2.13.16) мольных долей NI и Ns в уравнениях (2.15.12) на соответствующие концентрации. [36]
Все реальные растворы в той или иной степени отличаются от идеальных, следовательно, при любых давлениях дают отклонения от закона Рауля. Наиболее приближаются к идеальным растворам системы, составленные из компонентов сходного химического строения ( гомологов), при смешении которых не происходит ассоциации молекул или распада ассоциированных компонентов; в таких системах образование растворов из компонентов не сопровождается заметным изменением объема или тепловым эффектом. [37]
Все реальные растворы в той или иной степени отличаются от идеальных, следовательно, при любых давлениях дают от-клонения от закона Рауля. Наиболее приближаются к идеальным растворам системы, составленные из компонентов сходного химического строения ( гомологов), при смешении которых не происходит ассоциации молекул или распада ассоциированных компонентов; в таких системах образование растворов из компонентов не сопровождается заметным изменением объема или тепловым эффектом. [38]
Все реальные растворы в той или иной степени отличаются от идеальных, следовательно, при любых давлениях дают отклонения от закона Рауля. Наиболее приближаются к идеальным растворам системы, составленные из компонентов сходного химического строения ( гомологов), при смешении которых не происходит ассоциации молекул или распада ассоциированных компонентов; в таких системах образование растворов из компонентов не сопровождается заметным изменением объема или тепловым эффектом. [39]
Если реальный раствор является разбавленным, то для выражения зависимостей химических потенциалов компонентов от состава раствора могут быть использованы кроме ЛГ-шкалы другие концентрационные шкалы. [41]
Хотя реальные растворы и не подчиняются строго закону Рауля, но формула ( 93) оказывается часто пригодной для приближенных расчетов и в области не очень малых концентраций. [42]
Все реальные растворы в той или иной степени отличаются от идеальных, следовательно, при любых давлениях дают отклонения от закона Раул я. Наиболее приближаются к идеальным растворам системы, составленные из компонентов сходного химического строения ( гомологов), при смешении которых не происходит ассоциации молекул или распада ассоциированных компонентов; в таких системах образование растворов из компонентов не сопровождается заметным изменением объема или тепловым эффектом. [43]
Поэтому реальные растворы и соответствующие им графики удобно классифицировать по характеру отклонений от прямолинейной зависимости. [45]
Страницы: 1 2 3 4