Ионный раствор
Cтраница 4
Характер ближнего инфракрасного спектра ионных растворов, соответствующий изменениям температуры, подтверждает, что разрушающая способность ионов возрастает в последовательности I Вг - С1 - [57, 61, 180] и что ионы ОН - и F - обладают способностью упорядочивать структуру. Было найдено, что в указанной области спектра катионы оказывают относительно меньшее влияние на спектр воды, чем анионы. Однако последний ряд катионов представляется неожиданным. Такой порядок расположения иодидов не был подтвержден другими исследователями, но если окажется, что данные Люка [60] справедливы, то наблюдаемый порядок можно объяснить конкурирующим влиянием упорядочивателя структуры иона Li и разрушителя структуры иона 1 - ( разд. [46]
Успешное развитие современной теории ионных растворов обусловлено тем обстоятельством, что нам известен закон, которому подчиняются силы притяжения, действующие между попами. На основе этого закона и применения основных представлений электростатики, гидродинамики и статистической механики была развита точная теория, которая описывает свойства электролитов в тех случаях, когда силы междуионного притяжения являются преобладающими н когда можно пренебречь влиянием других сил, как, например, междумолекулярных сил и сил взаимного отталкивания ионов, проявляющихся при сближении попов на очень малые расстояния. Следовательно, построение теории должно начинаться с количественного изучения влиянии сил взаимодействия между ионами на все известные свойства ионных растворов. Если этот первый шаг будет сделан правильно и если полученные результаты будут подтверждены экспериментально при соответствующих условиях, тогда можно с известной надеждой на успех предпринять следующий шаг в доле выяснения свойств растворов электролитов на основании наблюдаемых отклонений от этих закономерностей. [47]
Бьеррум принимает простейшую модель ионных растворов - он рассматривает ионы как несжимаемые и неполяризующиося сферические частицы с радиусом а, находящиеся в среде с определенной макроскопической диэлектрической постоянной. При этом совершенно не учитываются неполярные квантовые связи между ионами, а также взаимодействие ионов с молекулами растворителя. [48]
Успешное развитие современной теории ионных растворов обусловлено тем обстоятельством, что нам известен закон, которому подчиняются силы притяжения, действующие между ионами. На основе этого закона и применения основных представлений электростатики, гидродинамики и статистической механики была развита точная теория, которая описывает свойства электролитов в тех случаях, когда силы междуионного притяжения являются преобладающими и когда можно пренебречь влиянием других сил, как, например, междумолекулярных сил и сил взаимного отталкивания ионов, проявляющихся при сближении ионов на очень малые расстояния. Следовательно, построение теории должно начинаться с количественного изучения влияния сил взаимодействия между ионами на все известные свойства ионных растворов. Если этот первый шаг будет сделан правильно и если полученные результаты будут подтверждены экспериментально при соответствующих условиях, тогда можно с известной надеждой на успех предпринять следующий шаг в деле выяснения свойств растворов электролитов на основании наблюдаемых отклонений от этих закономерностей. [49]
Бьеррум принимает простейшую модель ионных растворов - он рассматривает ионы как несжимаемые и неполяризующиеся сферические частицы с радиусом а, находящиеся в среде с определенной макроскопической диэлектрической постоянной. При этом совершенно не учитываются неполярные квантовые связи между ионами, а также взаимодействие ионов с молекулами растворителя. [50]
Ленард, применяя к ионным растворам закон Стокса, установил, что температурные коэффициенты Гд электропроводности этих растворов и движения макроскопических тел в жидкости в сущности одинаковы. В дальнейшем Н. Н. Улих доказал, что произведение Ц ( К0 для всех жидких сред с повышением температуры или остается постоянным, или несколько падает. Постоянным оно сохраняется в электролитах лишь при малых значениях А0, при этом Я0 увеличивается с ростом температуры. [51]
В разбавленных молекулярных или ионных растворах мицел-лообразование развивается в очень узкой области концентраций - при так называемой критической концентрации мицелло-образования - ККМ, в которой обнаруживаются резкие изменения свойств растворов. [52]
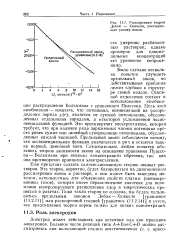 |
Расширенная теория Дебая - Хюккеля, учитывающая размер ионов. [53] |
Еще предстоит создать самосогласованную теорию ионных растворов. Эга теория, вероятно, будет базироваться на динамическом рассмотрении ионов в растворе, н она может быть выведена методом, используемым для объяснения свойств плазмы ( ионизированных газов), которая имеет первостепенное значение для понимания контролируемого растепления ядер н энергетических процессов в ракетах. Пока такая теория не создана, мы будем пользоваться предельным законом Дебая - Хюккеля [ уравнение (11.2.11) ] или расширенной теорией [ уравнение (11.2.14) ] и учтем, что предсказания теории верны только для низких концентраций. [54]
Теперь рассмотрим данные по НРН ионных растворов. Как и рассеяние рентгеновских лучей, НРН свидетельствует о том, что малые по размеру или многозарядные ионы благодаря своему полю легко разрушают структуру воды, образуя сильно координированные ион-водные комплексы. Большие ионы с низким зарядом также могут разрушать структуру воды, однако возникающая координация слабее, чем в чистой воде. Новые данные подтверждают, что некоторые ионы могут входить в структуру воды, искажая, но не разрывая ее. [55]
 |
Обобщенные потенциалы и радиусы ионов. [56] |
Эта схема слишком идеализирует состояние ионного раствора, так как не учитывает энергетическую неравноценность ионов ( У0) и возможность образования комплексных ионов, поэтому эта теория рассматривается как первое приближение. [57]
Эта гипотеза не противоречит теории ионных растворов Дебая - Хюккеля, предполагающей достаточно правильное пространственное расположение катионов и анионов. Пространственное чередование ионов по знаку зарядов вытекает из требования минимума потенциальной энергии их электростатического взаимодействия. Учет свободного ( теплового) движения ионов, требующий статистического подхода, существа картины не меняет. [58]
В процессе выпадения субмикрокристаллов из пересыщенного ионного раствора толщина прослоек жидкой фазы уменьшается и свойства ее изменяются. При относительно невысокой концентрации субмикрокристаллов их взаимодействие обусловливается вторичными связями, а по мере увеличения концентрации субмикрокристаллов проявляются первичные силы связи. Наличие тех или иных сил взаимодействия на различных стадиях формирования структуры цементного камня затрудняет или вовсе устраняет перенос новообразований из окружающих цементные частицы реакционных каемок в промежутки, ранее заполненные жидкой фазой. [59]
Для получения дистиллированной воды и концентрированного ионного раствора используется полупроницаемая мембрана. Высокое давление проталкивает сквозь мембрану воду, а большая часть растворенных солей удерживается. [60]
Страницы: 1 2 3 4