Простейший раствор
Cтраница 2
Вследствие этого теплота испарения компонентов из раствора оказывается большей, чем чистого компонента. Поэтому здесь давление насыщенного пара оказывается меньшим, чем соответствующих простейших растворов. Образование раствора из компонентов сопровождается в этом случае большей частью ( но тоже не всегда) у м ен ьш е-ниемобъема. [16]
Нужно иметь в виду, что такое решение не является точным. Подстановка активностей вместо концентраций позволяет учитывать влияние отклонения рассматриваемого раствора от простейших растворов. [17]
 |
Построение градуировоч. [18] |
Следует напомнить, что при практическом применении метода добавок необходимо придерживаться некоторых предосторожностей. Целесообразно предварительно приблизительно оценить содержание определяемого элемента в пробе, например, с помощью простейших растворов сравнения на водной основе, и после этого выбирать добавки, в которых содержание определяемого элемента будет соизмеримо с его содержанием в анализируемом растворе. В противном случае точки, определяющие положение графика, могут быть расположены либо очень близко, либо, наоборот, очень далеко от начала координат, что неизбежно повлияет на точность построения графика. [19]
С целью упрощения изучения ряда реальных растворов, введено некоторое гипотетическое понятие об идеальном или простейшем растворе, аналогично тому, как при изучении газов используется другое гипотетическое понятие-идеальный газ. [20]
Вместо активности нередко пользуются величиной коэффициента активности YI - Он равен отношению активности к концентрациии, например, для принятого нами выражения концентраций в мольных долях у ai / Ni и представляет собой тоже вспомогательную расчетную термодинамическую функцию. Коэффициент активности характеризует степень отклонения свойств рассматриваемого компонента в данном растворе от свойств его в соответствующем простейшем растворе. [21]
К расплавам первого типа относятся такие, избыточные изо-барный потенциал и энтропия которых примерно равны нулю ( zf - Sf - 0) Примером могут служить расплавы системы AgCl - PbClo. Диаграмма плавкости этой системы относится к эвтектическому типу, и свойства ее расплавов приближаются к свойствам простейших растворов. [22]
Вместо активности нередко пользуются величиной коэффициента активности YI - Он равен отношению активности к концентрации, и, например, для принятого нами выражения концентраций в мольных долях YI CLiINi и представляет собой тоже вспомогательную расчетную термодинамическую функцию. Коэффициент активности характер изует степень отклонения свойств рассматри-ваемо ТсГкомпонента в данном растворе от свойств его в соответ-ствуктщетгг простейшем растворе. Численное значение коэффициента активности зависит также от принятого способа выражения концентрации раствора. [23]
На рис. 77, б изображены кривые изменения избыточного изобарного потенциала хлористого свинца в зависимости от состава расплава и второго компонента. Расплавы системы РЬС12 - LiCl в основном характеризуются нулевым избыточным изобарным потенциалом и по этому признаку приближаются к простейшим растворам. Расплавы системы РЬС12 - NaCl уже отличаются от простейших растворов: избыточный изобарный потенциал имеет для них заметную отрицательную величину. Взаимодействие разнородных ионов в расплаве здесь значительное, однако не приводящее еще к комплексообразованию. RbCl резко отличаются от простейших растворов, что проявляется в еще большем отрицательном избыточном изобарном потенциале и согласуется с диаграммами плавкости соответствующих систем, где обнаруживается образование химических соединений: КРЬ2С15, К2РЬС14 в первом случае и RbPb2Q5, RbPbCU и Rb2PbCU - во втором. Экранирование иона свинца хлор-ионами настолько усиливается в таком расплаве, что приводит к возникновению в них комплексных анионов, которые обнаруживаются при измерении плотности, вязкости и электропроводности этих расплавов. [24]
Следует подчеркнуть, что увеличение химического потенциала означает повышение и химической активности. Например, этиловый спирт, растворенный в бензоле и в гексане, обладает более высокой активностью, чем растворенный в метиловом спирте, с которым он образует простейшие растворы. Так как это изменение химического потенциала для различных растворенных веществ может быть неодинаковым, то при проведении химической реакции в растворах положение химического равновесия в ней в зависимости от вида растворителя и концентрации раствора может существенно изменяться. [25]
В диаграмме, выражающей зависимость общего и парциальных давлений пара от состава, зтим соотношениям соответствуют прямые линии. Системы, в которых строго соблюдаются эти условия, называются простейшими. Подобные простейшие растворы называют также идеальными. [26]
Простейшие, или идеальные, растворы - это расплавы, построенные только из простых ионов, между которыми отсутствует взаимодействие, приводящее к комплексообразованию или ассоциации. Такое идеальное поведение компонентов получается в результате внутренней компенсации энергетической неоднородности ионов, образующих расплав. К простейшим растворам также относятся, по-видимому, расплавы двойных систем, образованных нитратами элементов первой и второй групп периодической системы. [27]
Таким образом, в простейших ( в термодинамическом отношении) растворах каждый компонент обладает той же внутренней энергией и той же энтальпией, что и в чистом состоянии. Следовательно, в этих состояниях одинакова и его теплота испарения. Энтропия и химический потенциал компонента в простейшем растворе отличаются от значений энтропии энергии Гиббса этого компонента a чистом состоянии на величину, однозначно определяемую при данной температуре содержанием этого компонента ( выраженным в мольных долях) и не зависящую от вида и относительного содержания остальных компонентов. [28]
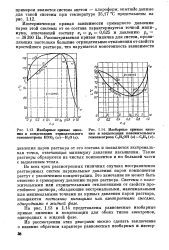 |
Изобарные кривые кипе - [ IMAGE ] Изобарные кривые кипения и конденсации отрицательного ния и конденсации положительного гомоазеотропа HNO3 ( ш - Н2О ( а. гомоазеотропа С2Н6ОН ( а - С6Н6 ( и. [29] |
Это замечание не может быть отнесено к суммарному давлению паров раствора. Системы с положительными или отрицательными отклонениями от свойств простейшего раствора, обладающие экстремальными, максимальными или минимальными точками на кривых давления паров раствора, называются постоянно кипящими или азеотропными смесями, однородными 6 жидкой фазе. [30]
Страницы: 1 2 3