Изученный раствор
Cтраница 1
Изученные растворы обнаруживают положительное отклонение от закона Рауля. В первом приближении термодинамическая активность тиофанов является одинаковой функцией составов для всего гомологического ряда. [1]
Для всех изученных растворов на одном графике строят зависимости С - Ей определяют потенциал нулевого заряда висмута, которому отвечает минимум на этих кривых. [2]
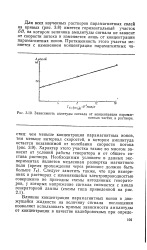 |
Зависимость ашштуды сигнала от концентрации парамагнитных частиц в растворе. [3] |
Для всех изученных растворов парамагнитных солей на кривых ( рис. 3.8) имеется горизонтальный участок БВ, на котором величина амплитуды сигнала не зависит от скорости потока и изменяется лишь от концентрации парамагнитных ионов. [4]
И здесь свойства изученных растворов близки к свойствам идеально концентрированных растворов Нернста. [5]
Полученные для всех изученных растворов перенапряжения откладывают на графике как функцию логарифма плотности тока. Определяют значения углового коэффициента Ь полученных кривых ц - lg /, который равен 2 3RT / a. F, и из них рассчитывают среднее значение коэффициента переноса а. Как видно из ур-авнения (3.58), в растворах разбавленных кислот перенапряжение не должно зависеть от концентрации кислоты. [6]
Итак, во всех мной изученных растворах метилового спирта, в растворах этилового спирта, содержащих от 10 до приблизительно 60 - 70 % этилового спирта, оба фактора перемещения изменяют состав пара в том же направлении. Потеря спирта превышает потерю, вычисленную по формуле механического перемещения системы. [7]
В табл. 2 приведены составы изученных растворов. [8]
Предпринятое нами сопоставление различных свойств изученных растворов позволяет сделать вывод, что особенности электронного строения растворенных ионов отражаются не только на характере взаимодействия их с ближайшими координационными частицами, но откладывают отпечаток на состоянии значительно более удаленных молекул, определяя свойства растворов в целом. Следовательно, свойства растворов не могут определяться чисто электростатическими характеристиками ионов, даже если речь идет только о внешнесферном взаимодействии. [9]
Произведено измерение критического напряжения для изученных растворов. Последнее изменяется в той же последовательности, как это имеет место и для начальной поляризации. Установлен определенный параллелизм между структурой катодного осадка и этими характеристическими величинами. [10]
Полученные значения потенциала катода для всех изученных растворов откладывают на графике как функцию логарифма плотности тока. Определяют угловые коэффициенты линейных участков кривых Е - lg /, которые согласно уравнению (3.54) равны 2 3 RT / aF, и рассчитывают значения коэффициента переноса а. Для постоянного потенциала Е - 1 25 В ( относительно нас. Определяют угловой коэффициент полученной зависимости, который в соответствии с уравнением (3.53) при постоянных Е и гр ] ( что имеет место в данном случае) равен порядку катодного процесса выделения водорода по ионам водорода. [11]
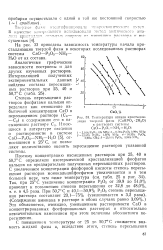 |
Температура начала кристаллизации твердой фазы ( СаНРО4 2Н2О. [12] |
Аналогичные графические зависимости построены и для других изученных растворов. [13]
 |
Относительное понижение давления пара. [14] |
Практически лишь ничтожное число из общего количества изученных растворов можно назвать идеальным. Для остальных растворов наблюдаются отклонения от закона Рауля. [15]
Страницы: 1 2 3 4 5