Концентрированный раствор - электролит
Cтраница 2
В концентрированных растворах электролитов вычисления проводят по активности воды или другого растворителя, которую, в свою очередь, можно рассчитать по четырем методикам. [16]
 |
Эквивалентная схема электролитической ячейки ( а без адсорбции и ( б с адсорбцией деполяризатора. [17] |
В концентрированных растворах электролитов R мало и первым членом уравнения (1.31) можно пренебречь. [18]
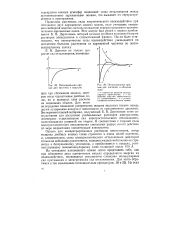 |
Потенциальная кривая для частичек в вакууме.| Потенциальные кривые для частичек в обычном золе. [19] |
Однако для концентрированных растворов электролитов, когда толщина двойных ионных слоев стремится к очень малой величине, и, следовательно, силы электростатического отталкивания действуют только на небольших расстояниях, толщина жидкостной пленки не стремится к безграничному утончению, а приближается к пределу, соответствующему мономолекулярному слою толщиной около 100 А. [20]
При взаимодействии концентрированных растворов электролитов с глинистыми частицами, как показано Б.В. Дерягиным, структура воды в граничной фазе разрушается, граничная вязкость приближается к значениям объемной вязкости, толщина ориентированных слоев воды у поверхности глинистых частиц уменьшается. Все это способствует повышению скорости капиллярной пропитки концентрированными растворами солей и уменьшению / Ссп при разбавлении растворов. [21]
В принципе для концентрированных растворов электролитов справедливы те же соображения, что и для концентрированных растворов неэлектролитов ( разд. [22]
Активности ионов в концентрированных растворах электролитов наглядно видны из рис 34, взятого из работы Китченера. На этом рисунке изображена зависимость средних коэффициентов активностей ряда солей известных одновалентных катионов и анионов от их молярных концентраций. На верхнем рисунке приведены кривые для толуолсульфонатов лития, натрия и калия и ацетатов цезия, рубидия, калия, натрия, лития, таллия, а также иодида триэтиламмония в интервале концентраций вплоть до четырехмолярной. Перечисленные соли, кроме последней, являются химическими аналогами катионитов с сульфо - ( соответственно карбоксильными) группами; последняя соль - аналогом сильноосновного анионита. На нижнем рисунке представлена зависимость i от молярной концентрации соли для солей одновалентных катионов с разными анионами. [23]
Применяя солевые мостики, содержащие концентрированные растворы электролитов ( насыщенный раствор КС1), можно снизить численную величину второго члена в правой части уравнения ( 68), однако и в этом случае остается совершенно произвольный первый член. [24]
Важнейшей составной частью теории концентрированных растворов электролитов должна явиться физическая теория, учитывающая силы электростатического взаимодействия между ионами и между ионами и молекулами воды. Примером такой теории является теория Дебая - Гюккеля и ее модификации. [25]
Для построения количественной теории концентрированных растворов электролитов, удовлетворяющей перечисленным требованиям, необходимы значительные совместные усилия физико-химиков экспериментаторов и теоретиков. [26]
В современных теориях электропроводности концентрированных растворов электролитов помимо конечных размеров ионов учитываются взаимодействие релаксационного и электрофоретического эффектов, локальные изменения вязкости вблизи ионов, асимметричность распределения концентрации в движущейся ионной атмосфере, образование ионных ассоциатов и другие эффекты. Однако чрезвычайная сложность этих теорий и громоздкий вид окончательных уравнений препятствуют их практическому использованию. [27]
В современных теориях электропроводности концентрированных растворов электролитов помимо конечных размеров ионов учитывают взаимодействие релаксационного и электрофоретичес-кого эффектов, локальные изменения вязкости вблизи ионов, асимметричность распределения концентрации в движущейся ионной атмосфере, образование ионных ассоциатов и другие эффекты. Однако чрезвычайная сложность этих теорий и громоздкий вид окончательных уравнений препятствует их практическому использованию. [28]
Если металл, покрытый концентрированным раствором электролита, возникшим благодаря начальным стадиям коррозии, или вследствие попадания посторонних солей, поместить в воздушную атмосферу, содержащую пары воды, то в силу разности парциальных давлений паров воды в атмосфере и над поверхностью раствора, покрывающего металл, немедленно начнется конденсация паров воды на поверхности металла. [29]
Кроме того, в концентрированных растворах электролита затрудняется перенос щелочи в анодное пространство и образуется меньше побочных продуктов электролиза. [30]
Страницы: 1 2 3 4