Концентрированный раствор - электролит
Cтраница 3
При изучении электропереноса в концентрированных растворах электролитов ( 1 М) следует также учитывать возможное смещение всей массы раствора вызванное изменением приэлектродных объемов жидкости в результате электролиза и различием в степени гидратации катионов и анионов. [31]
Ни одна из известных теорий концентрированных растворов электролитов не выдерживает такой серьезной проверки и не может претендовать на всеобщее признание. [32]
Гидрофильные коллоиды коагулируют от добавления концентрированных растворов электролитов или какого-либо дегидратирующего растворителя, например спирта. Коагуляция гидрофильных коллоидов концентрированными растворами электролитов называется высаливанием. [33]
Гидрофильные коллоиды коагулируют от добавления концентрированных растворов электролитов или дегидратирующего растворителя, например спирта. Коагуляция гидрофильных коллоидов концентрированными растворами электролитов называется высаливанием. Гидрофильные коллоиды гораздо устойчивее гидрофобных и при коагуляции дают студни ( или гели), которые с трудом отфильтровываются и промываются. [34]
Гидрофильные коллоиды коагулируют от добавления концентрированных растворов электролитов или какого-либо дегидратирующего растворителя, например спирта. [35]
В-форме приводят в равновесие с концентрированным раствором электролита ВХ, отделяют ионит от раствора и вымывают водой сорбированный электролит с последующим определением его количества по коиону; при этом количество электролита, перешедшего в воду, складывается из механически задержанного на поверхности гранул и молекуляр-но сорбированного фазой ионита. [36]
При рассмотрении ионообменных равновесий в концентрированных растворах электролитов с наибольшей полнотой выступает взаимосвязь учения о растворах и учения об обмене ионов. Свойства равновесного концентрированного раствора в значительной мере определяют селективность ионита. Кроме того, ионит, набухаемость которого изменяется в концентрированном растворе, с некоторым приближением можно трактовать как раствор электролита с изменяющейся концентрацией. [37]
Авторы обнаружили, что в концентрированных растворах электролитов понижение точки замерзания ненормально велико. Именно это обстоятельство - писал Джонс. Он показал, что как молекулы, так и ионы ( в более ярко выраженной форме) образуют с водой непрерывные ряды гидратов, имеющих всевозможные составы, начиная с одной молекулы и до 30 - 40 молекул воды. [38]
Однако ввиду отсутствия сколько-нибудь удовлетворительной теории концентрированных растворов электролитов желательно по возможности ограничить кинетические измерения более разведенными растворами, в которых первичный солевой эффект невелик, а вторичный солевой эффект может быть определен с достоверностью. [39]
С целью проверки изложенная выше теория концентрированных растворов электролитов была распространена на смешанные растворы [24] и с ее помощью вычислены кривые совместной растворимости в воде двух солей с общим ионом по опытным значениям коэффициентов активности водных растворов каждой из этих солей в отдельности. [40]
Семенченко [7] показал, что в концентрированных растворах электролитов в тех случаях, когда ионы сближаются на расстояние, при котором относительная кинетическая энергия меньше потенциальной энергии взаимодействия этих ионов, происходит образование ионной пары или квазимолекулы. [41]
Все эти данные позволяют предположить, что концентрированные растворы электролитов ведут себя как обычные органические неионоген-ные растворители. Ранее было установлено 15, что в концентрированных растворах электролитов, когда ионы сближаются на расстояния, при которых относительная кинетическая энергия меньше потенциальной энергии их взаимодействия, возникают квазимолекулы, последние можно рассматривать как диполи. СоответствеЕшо концентрированные растворы будут являться согласно этому представлению полярными растворителями, к которым применимы все основные эмпирические закономерности, найденные для полярных растворителей. [42]
Экспериментально установлено, что в статических условиях концентрированный раствор электролита диффундирует очень медленно с поверхности детали к промывной воде. [43]
Прибор АКК-9 предназначен для измерения удельной электропроводности концентрированных растворов электролитов, в том числе загрязненных и агрессивных, и преобразования измеренного значения в унифицированный сигнал О-5 мА постоянного тока. [44]
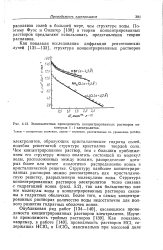 |
Эквивалентная проводимость концентрированных растворов некоторых 1. 1-электролитов. Точки - измеренные значения, линии - значения, рассчитанные по уравнению. [45] |
Страницы: 1 2 3 4