Разбавленный раствор - слабый электролит
Cтраница 1
Разбавленные растворы слабых электролитов близки по свойствам к идеальным растворам. Равновесие в таких растворах определяется константой диссоциации. Степень диссоциации слабого электролита, определенная для разбавленного электролита различными способами, дает удовлетворительные совпадения. Один из способов определения степени диссоциации слабого электролита основан на измерении осмотического давления, понижении давления пара, понижении температуры замерзания или повышении температуры кипения. В этом случае величина измеренного свойства для электролитов оказывается в i раз больше по сравнению с неэлектролитами, причем изотонический коэффициент i достаточно простым соотношением связан со степенью диссоциации. [1]
Для разбавленных растворов слабых электролитов, для которых теория диссоциации Арре-ниуса приложима, можно получить эффективную концентрацию с небольшой ошибкой, умножая моляраую концентрацию на степень диссоциации. [2]
В разбавленных растворах слабых электролитов допускают коэффициент электропроводности fx равным единице даже в том случае, когда степень диссоциации электролита меньше единицы. [3]
В разбавленных растворах слабых электролитов, имеющих малые степени диссоциации, коэффициенты активности ионов близки к единице. Свойства этих растворов определяются действительными концентрациями ионов. Однако и у слабых электролитов в присутствии сильных коэффициенты активности ионов становятся меньше единицы, а поведение самих ионов определяется активностями. [4]
В разбавленных растворах слабых электролитов вязкость раствора мало отличается от вязкости чистого растворителя. Поэтому подвижности ионов близки к подвижности ионов в бесконечно разбавленных растворах. [5]
В разбавленных растворах слабых электролитов, имеющих малые степени диссоциации, коэффициенты активности ионов близки к единице. Свойства этих растворов определяются действительными концентрациями ионов. Однако и у слабых электролитов в присутствии сильных коэффициенты активности ионов становятся меньше единицы, а поведение самих ионов определяется активностями. [6]
 |
Средние величины коэффициентов активности ионов. [7] |
В разбавленных растворах слабых электролитов, имеющих малые степени диссоциации, коэффициенты активности ионов близки к единице. Свойства этих растворов определяются действительными концентрациями ионов. Однако и у слабых электролитов в присутствии сильных коэффициенты активности ионов становятся меньше единицы, а поведение ионов характеризуется активностями. [8]
 |
Средние величины коэффициентов активности ионов. [9] |
В разбавленных растворах слабых электролитов, имеющих малые степени диссоциации, коэффициенты активности ионов близки к единице. Свойства этих растворов определяются общими концентрациями ионов. Однако и у слабых электролитов в присутствии сильных коэффициенты активности ионов меньше единицы, а поведение ионов характеризуется активностями. [10]
Уравнение (1.39) справедливо для разбавленных растворов слабых электролитов. [11]
Это отношение верно для разбавленных растворов слабых электролитов ( например, уксусная кислота, NH4OH), но нарушается для сильных электролитов ( например, КС1) и даже для концентрированных растворов слабых электролитов. Во-вторых, когда Аррениус развивал свою теорию, то вообще предполагалось, что сильные электролиты в твердом состоянии, например КС1, состоят из молекул. Изучение кристаллических структур таких солей показалЪ, однако, что они полностью ионизированы и в твердом состоянии. Предположив затем, что при бесконечном разбавлении соль полностью ионизирована, следовало бы объяснить не причину того, что коэфициент i больше единицы, i то, что в более концентрированных растворах он всегда бывает меньше двух. [12]
Уравнение (1.39) справедливо для разбавленных растворов слабых электролитов. [13]
Таким образом, для разбавленных растворов слабых электролитов эквивалентная электропроводность изменяется с концентрацией электролита из-за изменения степени диссоциации а. [14]
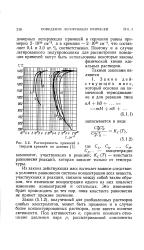 |
Растворимость примесей в твердом кремнии по данным. [15] |
Страницы: 1 2 3 4