Равновесный раствор
Cтраница 1
Равновесный раствор обладает постоянным удельным вращением ( при данных температурных условиях, составе растворителя и пр. [1]
Равновесный раствор обладает постоянным вращением плоскости поляризации ( при данных температурных условиях, составе растворителя и пр. [2]
Другой равновесный раствор, тоже пригодный для определения оснований, можно приготовить, действуя на растворы соли цинка избытком 8-оксихинолина ( НОх) с последующим фильтрованием. [3]
Если равновесный раствор был достаточно разбавлен, то поправка на содержание иона в удержанном электролите незначительна. [4]
Концентрация равновесного раствора, при которой в адсорбционном слое образуются двумерные ассоциаты гемимицелл, может быть названа критической концентрацией двумерной поверхностной ассоциации. Обозначим ее символом С ( р) асс. [5]
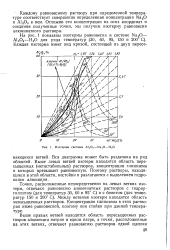 |
Изотермы системы А. 2О3 - - Na2O - Н2О. [6] |
Каждому равновесному раствору при определенной температуре соответствует совершенно определенная концентрация Na2O и А12О3 в нем. Отложив эти концентрации на осях координат и соединив полученные точки, мы получим изотерму равновесия алюминатного раствора. [7]
В равновесном растворе при этом концентрация дифильных молекул может быть намного ниже ККМ. [8]
В равновесном растворе ионы находятся в состоянии беспорядочного движения, при котором центральный ион и ионы, входящие в состав его ионной атмосферы, могут перемещаться как в одном и том же, так и в противоположных направлениях. Если рассматривать диффузию как процесс, связанный с незначительными отклонениями от равновесного состояния, то одной из ее движущих сил следует считать, в отличие от теории Нернста, не перепад осмотического давления, а разность реальных химических потенциалов. Другую силу следует отождествить, как и в теории Нернста, с электрическим полем, создаваемым в процессе движения противоположно заряженных ионов, перемещающихся с различными первоначальными скоростями. Необходимость использования реальных химических потенциалов заставляет ввести в уравнения диффузии коэффициенты активности ионов электролита. [9]
В равновесном растворе при этом концентрация дифильных молекул может быть намного ниже ККМ. [10]
В равновесном растворе, отделенном от осадка, можно легко обнаружить SOi - ионы. Образовавшийся в осадке карбонат бария легко отдает Ва2 - ионы при обработке раствором кислоты. [11]
В равновесном растворе или смеси химические потенциалы компонент равны. [12]
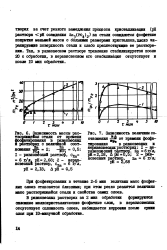 |
Зависимость массы растворяющейся стали от времени фосфатнрования в равновесных с величиной соот.| Зависимость величины со. [13] |
В равновесных растворах за 2 мин обработки формируются сплошные мелкокристаллические фосфатные слои, в неравновесных отсутствует сплошность слоев, наблюдается коррозия после сушки слоя при 10 минутной обработке. [14]
В равновесном растворе наряду с аномерными пиранозными формами присутствуют и фуранозные производные. [15]
Страницы: 1 2 3 4